Что значит гематоэнцефалический барьер
Гематоэнцефалический барьер разграничивает нервную систему от общего кровотока, обеспечивая постоянную и оптимальную по химическому составу среду для ее функционирования.
Межклеточная жидкость занимает 15 % общего объема мозга и окружает нейроны и нейроглию. Схема межклеточных пространств представлена на рисунке ниже. Секретируемая сосудистыми сплетениями спинномозговая жидкость циркулирует в системе желудочков и субарахноидальном пространстве и через пахионовы грануляции проникает в синусы твердой мозговой оболочки.
Затем спинномозговая жидкость путем пассивного транспорта через выстилающую стенки желудочков эпендимоглиальную мембрану проходит во внеклеточные пространства мозга, где смешивается с межклеточной жидкостью, продуцируемой клетками капилляров, и в процессе клеточного метаболизма распространяется через пиаглиальную мембрану в субарахноидальное пространство. «Стекание» спинномозговой жидкости компенсирует отсутствие лимфатических сосудов в ЦНС.
Единственная составляющая спинномозговой жидкости, которая не проникает через гематоэнцефалический барьер,— метаболическая жидкость. В ее состав входят нейромедиаторы, высвобожденные нейронами и не подвергнувшиеся обратному захвату, что обусловливает наличие неспособных преодолеть гематоэнцефалический барьер медиаторов и их метаболитов в субарахноидальном пространстве.
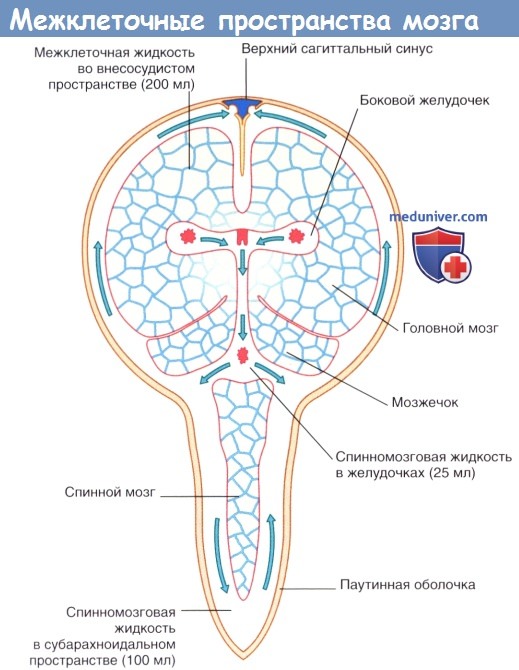
Стрелками показаны направления циркуляции спинномозговой жидкости.
Компоненты спинномозговой жидкости распределены следующим образом (по результатам поясничной пункции):
• жидкость, продуцированная клетками сосудистых сплетений, — 60 %;
• жидкость, продуцированная клетками капилляров, — 30 %;
• метаболическая жидкость — 10%.
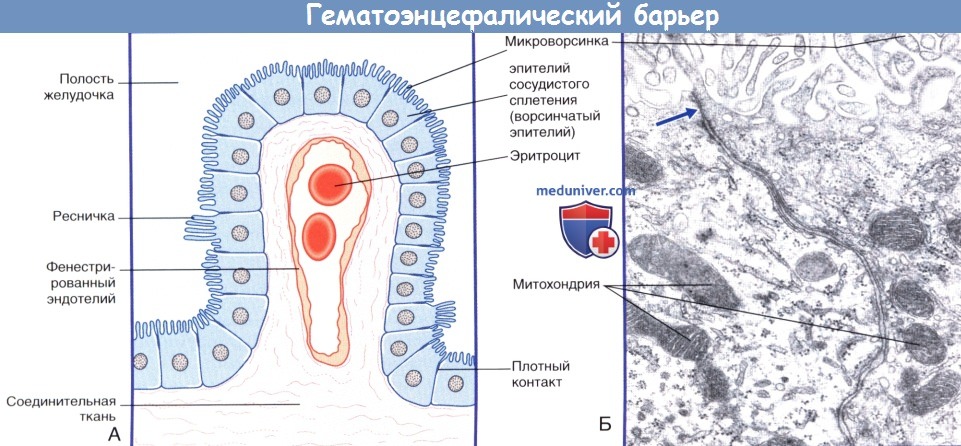
(Б) Ультраструктура эпителия сосудистого сплетения. В эпителиальных клетках расположены множество митохондрий и гранулярная эндоплазматическая сеть.
Клетки соединены плотными контактами в апикальной части.
Гематоэнцефалический барьер состоит из двух компонентов. Первый представлен барьером между кровью и спинномозговой жидкостью на уровне сосудистых сплетений, а второй — барьером между кровью и межклеточной жидкостью на уровне капилляров ЦНС.
а) Барьер между кровью и спинномозговой жидкостью. Барьер между кровью и спинномозговой жидкостью представлен эпендимальным эпителием сосудистых сплетений, который характеризуется следующими особенностями строения.
1. Практически все реснички замещены микроворсинками.
2. Клетки образуют плотные контакты. Именно эти места плотного соединения мембран клеток разграничивают кровь и спинномозговую жидкость.
3. Клетки эпителия содержат ферменты, обеспечивающие транспорт ионов и продуктов метаболизма.
б) Барьер между кровью и межклеточной жидкостью. Барьер между кровью и межклеточной жидкостью представлен эндотелием капилляров ЦНС, который характеризуется следующими особенностями строения.
1. Эндотелиоциты образуют плотные контакты.
2. В состав клеток входит небольшое количество пиноцитозных пузырьков, а также отсутствуют фенестрации.
3. Транспортные системы в клетках аналогичны таковым в эпителии сосудистых сплетений.
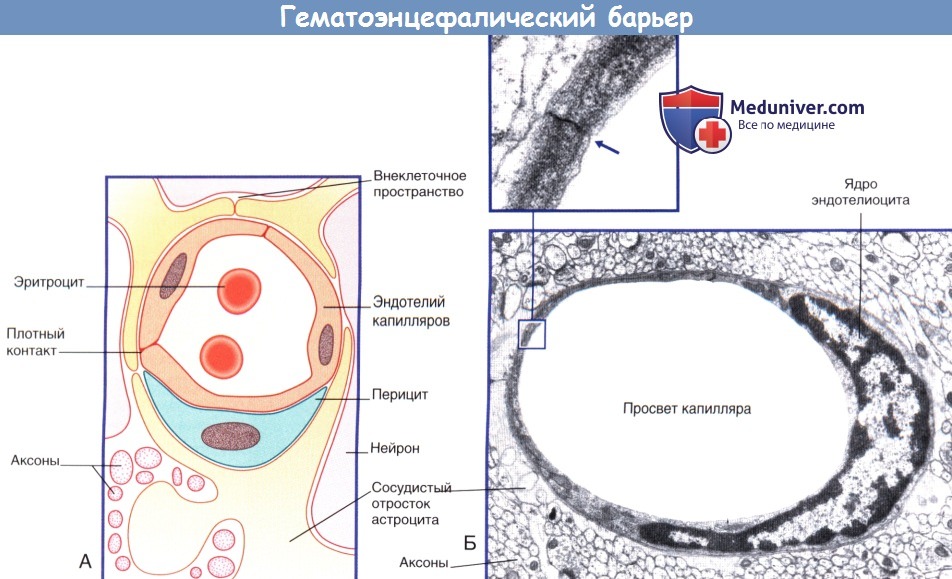
(Б) Капилляр центральной нервной системы. На поперечном срезе показан одиночный эндотелиоцит, полностью окружающий просвет сосуда.
Края эндотелиоцитов образуют плотный контакт. Эндотелиоцит окружен базальной мембраной. Капилляр окружен отростками астроцитов.
в) Функции перицитов капиллярного русла. Перициты и клетки эндотелия связаны с помощью щелевидных контактов. В ходе исследований культур клеток было достоверно доказано, что перициты играют ключевую роль в ангиогенезе капилляров, а также в формировании и поддержании плотных контактов между эндотелиоцитами.
Перициты принимают участие в саморегуляции мозгового кровотока за счет того, что на их поверхности экспрессируются рецепторы к вазоактивным медиаторам: норадреналину, вазопрессину, ангиотензину II. При хронической артериальной гипертензии развиваются гипертрофия и гиперплазия перицитов, а также происходит внутриклеточная продукция цитоплазматических сократительных филаментов, что обеспечивает компенсаторное расширение капилляров.
Поверхность клеточной стенки перицитов способна обеспечивать связывание протромбинового комплекса, за счет чего перициты могут принимать участие в процессе свертывания крови.
Кроме того, перициты обладают способностью к фагоцитозу и свойствами иммунорегуляторных цитокинов.
Общая площадь капиллярного русла головного мозга соответствует размерам теннисного корта! Наличие такой огромной поверхности объясняет тот факт, что мозг потребляет 20 % поступающего кислорода. Плотность капилляров коры головного мозга можно оценить на изображении латексного слепк.
г) Функции гематоэнцефалического барьера:
• Контроль проникновения метаболических веществ. Основной источник питания нейронов — глюкоза. При повышении уровня глюкозы в крови специфический белок-переносчик связывает ее, а при низком уровне — обеспечивает более активный захват.
• Контроль транспорта ионов. Nа + /К + -АТФ-аза клеток гематоэнцефалического барьера осуществляет транспорт ионов Na + в спинномозговую жидкость, а ионов К + —в кровь.
• Предотвращение поступления в мозг токсических веществ и периферических нейромедиаторов, выделяемых вегетативными нервными окончаниями в системный кровоток.
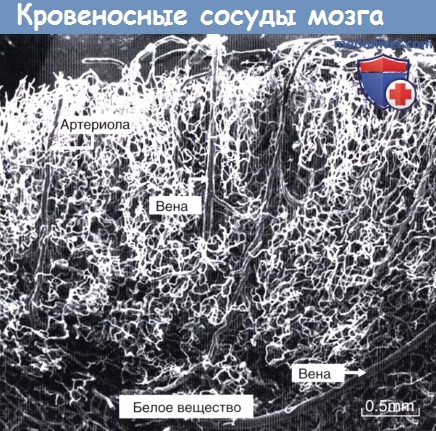
Корковые капилляры имеют вид извилистых белесоватых нитей.
д) Состояния, связанные с нарушением гематоэнцефалического барьера:
1. Пациенты с артериальной гипертензией подвержены приступам гипертонической энцефалопатии в связи с тем, что степень повышения давления превосходит компенсаторные способности стенок артериол. Вследствие такого повышения давления может произойти нарушение плотных межклеточных контактов эндотелия капилляров, что приводит к отеку мозга за счет быстрого выхода плазмы. Клинически эта ситуация проявляется сильной головной болью, рвотой и, в некоторых случаях, появлением судорог и развитием комы.
2. У пациентов с повышенным содержанием углекислого газа в крови (при заболеваниях дыхательной или сердечно-сосудистой системы, а также после хирургических вмешательств) причиной отека мозга даже при нормальном уровне артериального давления может стать расслабление мышечного слоя артериол. Данная ситуация клинически проявляется спутанностью сознания и сонливостью, в дальнейшем переходящими в кому.
3. Повреждения мозга (травмы или спонтанные кровоизлияния) приводят к отеку мозга вследствие осмотического повреждения тканей мозга (и других факторов).
4. Инфекционные заболевания мозга или его оболочек сопровождаются нарушением гематоэнцефалического барьера, предположительно из-за усиленного перемещения лейкоцитов в капиллярном русле мозга. Несостоятельность гематоэнцефалического барьера играет и положительную роль: стенки капилляров проницаемы для жирорастворимых антибиотиков.
Кроме того, капилляры опухолей мозга характеризуются наличием фенестраций, что позволяет идентифицировать злокачественное новообразование при помощи рентгеноконтрастного вещества, неспособного пройти через капилляры непораженных отделов мозга.
е) Резюме. Гематоэнцефалический барьер — барьер между кровью и спинномозговой жидкостью представлен эпителием сосудистых сплетений (видоизмененным эпендимным эпителием) желудочков мозга. Барьер между кровью и межклеточной жидкостью представлен эндотелием капилляров мозга.
Редактор: Искандер Милевски. Дата публикации: 10.11.2018
Источник
Гемато — энцефалический барьер
Опубликовано ср, 15/08/2018 — 16:28
Гематоэнцефалический барьер (ВВВ) является критической границей между центральной нервной системой (ЦНС) и периферией. ВВВ одновременно и «друг», и «враг» врачу — клиницисту. Защищая ЦНС от воздействия потенциально вредных веществ, находящихся в системном кровообращении, ВВВ одновременно представляет собой серьезное препятствие для доставки и поступления лекарств в ЦНС.
Анатомически, BBB представляет собой обширную сеть микрокапилляров протяженностью
650 км, каждый из которых имеет диаметр просвета
6 мм и окружен одиночной, эндотелиальной клеткой, люминесцентная и абламинальная (мозговая оболочка) мембраны разделены на 300-500 нм цитоплазмы. Вещества, пытающиеся перейти из системного кровообращения в ткань мозгуа должны либо пройти через парацеллюлярный путь ( как бы между влеток) или через трансцеллюлярный путь, проходя через микрососудистые эндотелиальные клетки. Парацеллюлярная диффузия водорастворимых веществ и малых ионов строго ограничена плотными соединениями (TJs), которые как бы соединяют мембраны эндотелиальных клеток для , чтобы физически закрыть межэндотелиальный разрыв. Вещества , пытающиеся пройти через мембрану микрососудистых эндотелиальных клеток, активно высвобождаются обратно в капиллярный просвет с помощью встроенных транспортеров оттока или воздействуют на различные метаболизирующие фермент — совокупные усилия «пассивной обструкции» (TJs).
Гематоэнцефалический барьер (BBB) — это не статическая анатомическая граница, а динамический интерфейс, способный быстро реагировать на стрессоры, включая гипоксию, воспаление, травму и боль. Повреждение целостности ВВВ подвергает мозг потенциально опасным концентрациям веществ , находящихся в периферическом кровообращении (например, ионы, аминокислоты, нейротрансмиттеры, белки и другие макромолекулы), которые могут нарушать гомеостаз мозга и отрицательно влиять на активность нейронов. Поврежденный парацеллюлярный проход лекарственных средств, нутрицевтиков или ксенобиотиков в мозг после нарушения «пассивной обструкции» (TJ) может привести к значительным побочным эффектам препарата и / или неблагоприятным взаимодействиям лекарственных средств. Альтернативно, нарушение BBB может включать патологически повышенный «отток» лекарственного средства из тканей мозга через микрососудистую (просветную ) мембрану, что приводит к снижению концентрации и эффективности лекарственного средства, находящегося в тканях мозга.
На целостность и функцию ВВВ оказывает сильное влияние то, что сейчас называют «расширенной нейрососудистой единицей или блоком» (“extended neurovascular unit”), которая включает в себя не только микрососудистые эндотелиальные клетки и смежные перициты, астроциты и нейроны, но также соседние клетки гладкой мускулатуры и микроглии в мозге, а также клетки крови, находящиеся в капиллярном просвете, например, таких как полиморфноядерные клетки, лимфоциты и моноциты. У
Учитывая наличие множества типов клеток, внутри- и внеклеточных сигнальных путей и взаимодействующих белков, липидов и углеводов, участвующих в образовании, поддержании и нарушении различных барьерных функций, выполняемых ВВВ, сегодня разработано и множество подходов к диагностике нарушений ВВВ и терапевтическому воздействию на гематоэнцефалический барьер ( BBB) как в области патологии , так и в аспекте терапии болезней с целью оптимизации доставки лекарств в ЦНС. На молекулярном уровне предложен подход, направленный на воздействие на функции конкретного белка, важного для биохимии ВВВ (например, транспортера эффлюка, компонента TJ), что является прямой модуляцией его активности и / или транскрипции генов. Альтернативным подходом улучшения доставки лекарств для ЦНС через ВВВ , является нацеленность на обмен белками и их местоположением , в результате чего изменение местоположения белка используется в качестве средства модуляции его активности. Можно привести два примера с участием P-гликопротеина-транспортера, используемого для «оттока» лекарственного средства и транслюмбронного белка окклюдина TJ, которые демонстрируют потенциал терапевтической модуляции индуцированных патологией изменений в обмене белками BBB с целью оптимизации доставки лекарственного средства в ЦНС в присутствии стрессоров (например, периферическая воспалительная боль, гипоксия).
P-гликопротеин (ABCB1 / MDR1) является выдающимся молекулярным открытием доставки лекарственного средства в ЦНС через ВВВ. Стратегически обогащенный на мембране церебральных микрососудистых эндотелиальных клеток, P-гликопротеин использует энергию от АТФ-гидролиза, чтобы вытеснить лекарства обратно в микрокапиллярный просвет против крутых градиентов концентрации.
P-гликопротеиновые субстраты имеют массу от 300-4000 Да и включают анальгетики, противораковые препараты и иммунодепрессанты, психотропные средства, антибиотики, антиаллергенные средства, противоэпилептические препараты , бета-блокаторы, стероидные гормоны и ингибиторы протеазы ВИЧ-1. Несмотря на интенсивные исследования, усилия сосредоточенные на разработке ингибиторов Р-гликопротеина, а также клинические испытания включающие прямое ингибирование Р-гликопротеина в значительной степени оказались неудачными в плане повышения терапевтической эффективности. Высокие дозы ингибитора, по-видимому, здесь необходимы, но , к сожалению, приводят к системному токсикозу. Более того, полное ингибирование P-гликопротеина может быть опасным для жизни из-за отсутствия защиты от потенциально опасных веществ, передающихся через кровь. В настоящее время усилия ученых направлены на выявление целевых показателей терапии в рамках нескольких сигнальных путей, которые способствуют связанным с болезнями изменениям активности P-гликопротеина.
Исследователями было обнаружено, что начало периферической воспалительной боли (экспериментально вызванное инъекцией λ-каррагинана в задней лапы животного ) наблюдается в течение трех часов за счет увеличения оттока морфина, связанного с P-гликопротеином, через гематоэнцефалический барьер ( BBB). Эти данные показали , что боль, вызванная процессом воспаления, сама по себе препятствует способности клинически значимых антиболевых препаратов , таких как морфин , поступать в ткани мозга. Воспаление, вызванное повреждением ткани, способствует выраженности послеоперационной боли, и поэтому вывод об увеличении оттока морфина с помощью P-гликопротеина через BBB может частично объяснить трудности с достижением послеоперационной опиоидной анальгезии.
Эволюционный выбор P-гликопротеина, который является основным «привратником» , регулирующим проход через BBB, можно определить из-за того, что микрососуды на BBB содержат самые высокие уровни P-гликопротеина в организме и что in vivo исследования дозирования с использованием P-гликопротеиновых субстратов показывают, что поглощение мозга существенно увеличивается у животных с нокаутом P-гликопротеина .
Учитывая тот факт , что диета, воздействие окружающей среды или внешние стрессоры могут быстро повышать концентрацию потенциально вредных веществ в системном кровообращении, можно предположить , что по мере развития P-гликопротеина для выполнения столь значимой барьерной роли для ВВВ, этот механизм должен также обеспечить своевременную доставку достаточного количества P-гликопротеина в микрососудистую люминесцентную мембрану для борьбы с какой-либо угрозой.
Трансмембранный протеин — окклюдин является значимым для барьерной функции при TJs между микрососудистыми эндотелиальными клетками гематоэнцефалического барьера (BBB), а изменение концентрации окклюдина от TJs является чувствительным, ранним и надежным признаком открытия TJ и дисфункции ВВВ. Способность быстро закрывать нарушения ВВВ (т. е. его повышенной проницаемости ) при TJs, которые наблюдаются во время окислительного стресса (например, вследствие инсульта), будет препятствовать развитию опасного для жизни отека головного мозга и проникновению в ткани ЦНС нейротоксичных веществ, передающихся через кровь. Периферическая воспалительная боль, индуцированная в трех разных экспериментальных моделях (формалин, каррагенан и полный адъювант Фрейнда), способствовала развитию дисфункции ВВВ, характеризующейся повышенной проницаемостью парацеллюлярных клеток к сосудистым маркерам, таким как сахароза. Было также обнаружено, что периферическая воспалительная боль способствует увеличению проницаемости парацеллюлярной расщелины для опиоидного анальгетического кодеина.
Кодеиновая анальгезия опосредованно централизована, что требует ее накопления в головном мозге, что и происходит при пассивной парацеллюлярной диффузии. Неконтролируемое увеличение потребления мозгом кодеина во время периферической воспалительной боли из-за патологического увеличения парацеллюлярной проницаемости может привести к значительным побочным эффектам ЦНС, связанным с опиоидами, такими как угнетение дыхания, зависимость и повышенная толерантность.
Гематоэнцефалический барьер (ВВВ) представляет собой физический и метаболический барьер, который отделяет ЦНС от периферического кровообращения. Доставка лекарств в ЦНС (CNS) через BBB является сложной задачей, в первую очередь из-за физического ограничения парацеллюлярной диффузии между эндотелиальными клетками, которые содержат микрососуды ВВВ, и активности транспортеров оттока, которые быстро вытесняют обратно в капиллярный просвет широкий спектр ксенобиотиков. В заключении отметим, что терапевтическое манипулирование трафиком P-гликопротеинов представляет собой относительно недорогой и неспецифический подход для усиления доставки лекарств в ЦНС (множества лекарств) и выбора оптимальных комбинаций лекарственных средств. Субстратами, влияющими на активность Р-гликопротеиновой транспортной системы, являются дигоксин, циметидин, такролимус, нифедипин, кетоконазол и амитриптилин.
Нифедипин — селективный блокатор кальциевых каналов II класса, производное дигидропиридина. Тормозит поступление кальция в кардиомиоциты и клетки гладкой мускулатуры сосудов. Оказывает антиангинальное и гипотензивное действие.
Источник



