- Уплотнение аорты сердца на эхокардиографии
- Атерома грудной аорты на эхокардиографии
- Эхокардиографическое обследование при уплотнении аорты
- Ассоциация атеромы грудной аорты и инсульта на эхокардиографии
- Эмболия во время манипуляции с аортой
- Ведение пациентов с атеромой аорты
- Общий подход к оценке атеросклероза аорты на эхокардиографии
- Влияние эхокардиографии на ведение пациентов
- Кардиоэмболические события, связанные с вмешательством
- Новая пероральная антикоагулянтная терапия (NOAC)
- Макроскопический и органометрический анализ сердца в патологии (часть 2)
- ТРИКУСПИДАЛЬНЫЙ КЛАПАН
- АОРТАЛЬНЫЙ КЛАПАН
- КЛАПАН ЛЕГОЧНОЙ АРТЕРИИ
- ОБЪЕМНЫЕ ИЗМЕРЕНИЯ ПОЛОСТЕЙ СЕРДЦА
- МЕТОД ИЗМЕРЕНИЯ ПОЛОСТЕЙ СЕРДЦА по Д.В.СВИЩЕВУ
- РАЗДЕЛЬНОЕ ВЗВЕШИВАНИЕ ЧАСТЕЙ СЕРДЦА
- Нормальные значения массы абсолютных весовых показателей частей сердца
- ОЦЕНКА ПОКАЗАТЕЛЕЙ РАЗДЕЛЬНОГО ВЗВЕШИВАНИЯ ЧАСТЕЙ СЕРДЦА
- АБСОЛЮТНЫЕ ПОКАЗАТЕЛИ РВЧС
- ПРОВОДЯЩАЯ СИСТЕМА СЕРДЦА
- ОСЛОЖНЕНИЯ ПРИ ЭЛЕКТРОСТИМУЛЯЦИИ СЕРДЦА
- НОРМАТИВЫ ОРГАНОМЕТРИЧЕСКИХ ПОКАЗАТЕЛЕЙ СЕРДЦА
- Список литературы
- Оглавление
- похожие статьи
Уплотнение аорты сердца на эхокардиографии
Атерома грудной аорты на эхокардиографии
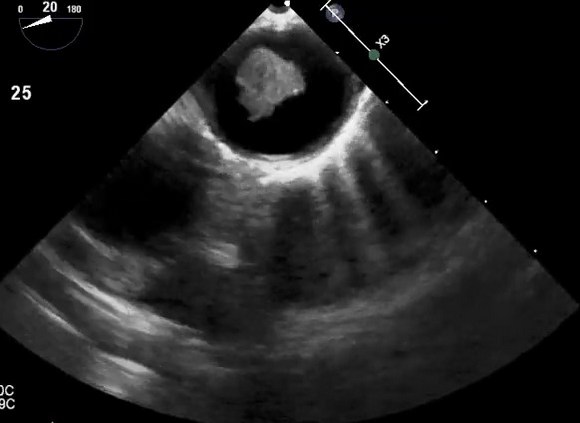
Атерома грудного отдела аорты обычно адекватно не визуализируется с помощью трансторакальной эхокардиографии и чаще всего в заключении пишут об уплотнении аорты. Таким образом, предпочтительным методом визуализации является ЧПЭхоКГ. Обычно аорта делится на три части: восходящая часть, дуга аорты и нисходящая аорта. С точки зрения риска церебральной эмболии наибольший интерес представляют восходящая грудная аорта и дуга аорты, проксимальнее места начала левой общей сонной артерии. При чреспищеводной эхокардиографии корень аорты лучше всего виден в продольной оси аортального клапана (
120°). Незначительное выдвижение датчика с уменьшением угла поворота (
90–100°) даст удовлетворительную визуализацию по длинной оси восходящей аорты в виде трубчатой структуры. На стыке верхней восходящей аорты и дуги аорты имеется эхокардиографическое слепое пятно из-за взаимного расположения левого главного бронха. Визуализация нисходящей аорты начинается в трансжелудочном разрезе.
Эхокардиографическое обследование при уплотнении аорты
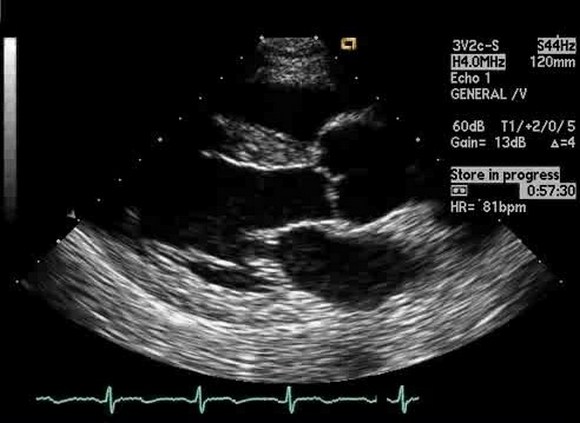
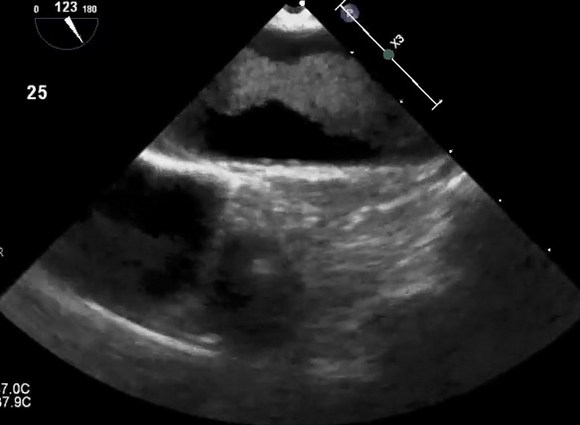
Атеросклеротические изменения грудной аорты все чаще признаются потенциально важным источником эмболии. Обычно сообщается о вращении ультразвукового зонда, при котором нисходящая грудная аорта попадает в окно визуализации. Нисходящая аорта находится позади и очень близко к верхней части желудка и пищевода, и глубина плоскости изображения должна быть отрегулирована для увеличения аорты.
Зонд постепенно извлекается, чтобы визуализировать всю нисходящую аорту грудного отдела, которая при 0° вращения появляется на ее короткой оси. Любое отклонение от нормы, начиная с уплотнения стенок, следует оценивать по его короткой и длинной осям с визуализацией при вращении 0 ° и 90 ° соответственно. Когда зонд введен на глубину примерно на 20 см от резцов, начнет появляться дуга аорты. Лучше всего это визуализировать, повернув зонд кпереди, чтобы открыть вид по длинной оси аорты и визуализировать истоки магистральных сосудов. Визуализация дуги аорты обычно сохраняется до конца исследования, поскольку многие пациенты испытывают рефлекторное рвотное движение от датчика в этом положении и считается его наиболее неудобной частью исследования, требующей его удаления. Эхокардиография может отличить слой интима-медиа сосуда от окружающих тканей, а также обнаруживает изменение между прилегающими тканями и яркой адвентицией. Поэтому для целей количественной оценки стандартно измерять толщину до уровня ярких адвентиций и маркировать это как толщину «атеромы» при уплотнении аорты. Традиционно атерома аорты классифицируется с использованием балльной системы I–IV, хотя, вероятно, лучше измерить глубину (толщину) бляшки и описать ее характеристики (наличие участков изъязвления, кальциноза, сидячей или педункулированной (на ножке) и / или степени поражения, подвижность атеромы). При гистологическом сравнении чреспищеводная эхокардиография при уплотнении аорты показала хорошую корреляцию в разделении нормального и минимального утолщения интимы от более сложных атером (93% совпадение) со 100% совпадением в обнаружении мобильного тромба.
Ассоциация атеромы грудной аорты и инсульта на эхокардиографии
Наблюдательные серии случай-контроль показали значительно более высокую распространенность сложной атеромы (подвижная или изъязвленная бляшка и бляшка толщиной> 4 мм) у пациентов с инсультом (21–27%) по сравнению с контрольной группой (4–13%). В проспективных исследованиях частота инсульта через 1 год у пациентов с выступающей атеромой составила 12%, а частота всех эмболических событий — 33%. Комбинация фибрилляции предсердий и сложной аортальной бляшки связана с более высоким риском инсульта (12–20% в течение 1 года) по сравнению с риском инсульта 1–2% для пациентов с фибрилляцией предсердий без значительного уплотнения аорты и бляшек. Независимо от антикоагуляции или аспирина, это еще одно свидетельство того, что независимый значительный эмболический потенциал связан с атеромой аорты. На распространенность инсульта или других эмболических событий, по-видимому, влияет морфология бляшек. Размер бляшек (толщина), кальцификация атеромы и их подвижность — все это важные характеристики. Увеличение толщины атеромы на эхокардиографии связано с более высоким риском инсульта с порогом 4 мм, в частности, связано со значительно более высоким риском инсульта. Значение видимого изъязвления бляшек неясно с имеющимися данными, предполагающими, что изъязвление в более тонких бляшках связано с повышенным риском, в то время как эта взаимосвязь не значима в более толстых (> 4 мм) бляшках. Наличие кальцификации в бляшках связано со снижением риска эмболических событий, что, вероятно, объясняется тем фактом, что кальцификация, скорее всего, представляет собой наличие более хронических фиброзных бляшек с меньшим содержанием липидов. Мобильные компоненты атеромы аорты также связаны с повышенным риском эмболии с эхопатологической корреляцией, предполагающей, что эти мобильные элементы являются тромбом. Основываясь на текущих данных, похоже, что большинство эмболических событий, связанных с атеросклерозом аорты, являются вторичными по отношению к эмболизации тромбом, который образовался на этих атеросклеротических поражениях.
Эмболия во время манипуляции с аортой
Существует риск эмболии при манипуляциях на аорте во время кардиохирургических операций или катетеризации левых отделов сердца. Эмболические осложнения при катетеризации сердца редки (частота инсульта 0,5%). Однако, когда все же возникают эмболические осложнения, часто встречается атерома аорты. Сообщаемая частота эмболических осложнений во время кардиохирургических вмешательств с использованием искусственного кровообращения составляет 2–7%. Пациенты с атеромой аорты> 5 мм на ЧПЭхоКГ имеют значительно более высокий риск интраоперационного инсульта. Интраоперационная или эпикардиальная эхокардиография используется для оценки аорты, чтобы помочь стратифицировать риск этих пациентов и найти безопасную точку для введения канюли и пережатия.
При эпикардиальной эхокардиографии используется высокочастотный малогабаритный (трансторакальный) датчик, покрытый стерильной оболочкой, помещенный непосредственно на аорту для визуализации восходящей аорты и дуги аорты с отличным разрешением. «Стойка» (перчатка, заполненная физиологическим раствором) может увеличить расстояние между датчиком и аортой, обеспечивая удовлетворительную визуализацию передней стенки, которую бывает трудно увидеть (слишком близко), если датчик размещен непосредственно на аорте.
Ведение пациентов с атеромой аорты
Не существует единого мнения относительно оптимального ведения пациентов со сложной атеромой аорты. Использование антитромботических агентов и / или антикоагулянтов представляется логичным, учитывая ключевую роль тромба в эмболических событиях. Терапия аспирином обычно назначается всем пациентам со значительным атеросклеротическим заболеванием. Также обычно рассматриваются ингибиторы HMGCo-A-редуктазы (статины) с их документально подтвержденными преимуществами у людей с атеросклерозом. Уменьшение частоты инсульта было зарегистрировано у пациентов с гиперлипидемией, а также у пациентов с более «нормальным» уровнем холестерина. Несмотря на то, что антикоагулянтная терапия не была проспективно оценена для пациентов с атеромой аорты, данные наблюдений предполагают, что она, вероятно, полезна.
Тромбэктомия и эндартерэктомия сложной атеромы дуги аорты могут рассматриваться как хорошие кандидаты на хирургическое вмешательство с рецидивирующими эмболическими событиями, несмотря на оптимальную медикаментозную терапию. Однако такой подход связан с высоким уровнем неврологических и сосудистых осложнений.
Общий подход к оценке атеросклероза аорты на эхокардиографии
Сердечно-сосудистый источник эмболии все чаще выявляется при обследовании пациентов с острой церебральной, периферической или висцеральной ишемией. Большинство отчетов сосредоточено на источниках эмболии у пациентов с инсультом. Как уже отмечалось, уровень доказательств, демонстрирующих убедительные причины и следствия, ограничен, и эти потенциальные источники лучше всего описывать как «ассоциации», а не как убедительные причины. Важно тщательно оценить пациентов на предмет всех потенциальных источников, и не исключено обнаружение у него более одного потенциального источника, тем более что распространенность многих из этих факторов увеличивается с возрастом. Кроме того, как заболевание сонной артерии, так и атерома грудной аорты являются проявлениями одного и того же патологического процесса, и неудивительно, что пациенты со значительным атеросклерозом сонных артерий имеют более высокую распространенность атеросклероза дуги аорты, чем пациенты без заболевания сонных артерий. Следовательно, может потребоваться оценка аорты, особенно если неврологическое событие контралатерально стенозу сонной артерии или если заболевание сонной артерии связано с периферическими или висцеральными эмболами.
Влияние эхокардиографии на ведение пациентов
Как только наступила острая фаза неврологического события, основная цель — выявить любые потенциально излечимые источники и предотвратить повторяющиеся, потенциально фатальные события. Данные показывают, что частота рецидивов для всех подтипов инсульта составляет 9,4% в год и 10% для криптогенного инсульта. Сообщается, что чреспищеводная эхокардиография полезна для стратификации риска у пациентов после инсульта. Одна серия пациентов, за которыми наблюдали в течение 2 лет и которые были разделены на группы низкого и высокого риска (на основании наличия хотя бы одного вероятного или возможного фактора риска эмболии при ЧПЭхоКГ), показала, что пациенты из группы низкого риска чувствовали себя значительно лучше (выживаемость составила 92% против 63%, p = 0,04). В исследовании STEPS (242 пациента после ЧПЭхоКГ по поводу необъяснимого инсульта)при уплотнении аорты, демонстрировала атерому аорты и дилатацию ЛЖ, выявила подгруппы с высоким риском повторного инсульта при лечении одним аспирином, что указывает на потенциальную роль эхокардиографии в помощи в выборе терапии и ее влиянии на исход после индексного церебрального события. Однако необходимы проспективные исследования, чтобы определить, можно ли преобразовать идентификацию предикторов рецидива инсульта в улучшение результатов лечения пациентов.
Кардиоэмболические события, связанные с вмешательством
При расширенном использовании вмешательств во время лечении сердечно-сосудистых заболеваний наблюдались побочные эффекты, такие как ятрогенные инсульты и системная эмболизация. Коронарная ангиография, одна из наиболее широко используемых процедур, наряду с чрескожной реваскуляризацией, произвела революцию в лечении ИБС. Однако, когда инсульт усложняет эти процедуры, он сводит на нет получаемые от него преимущества и ускоряет нанесение вреда. Использование определенных методов может помочь снизить этот риск. Исследователи показали, что промывание катетеров в нисходящей аорте с последующим продвижением к корню аорты значительно снизило частоту микроэмболизации по сравнению со стандартным препарированием катетера в восходящей аорте.
Кроме того, сведение к минимуму количества маневров с катетером значительно снижает риск микроэмболизации головного мозга. Также, было обнаружено, что левый лучевой доступ имеет меньший риск эмболизации мозга, чем правый лучевой. Этот результат был в основном связан с меньшим количеством маневров катетера, необходимых для левостороннего лучевого доступа. Более того, технологические достижения позволили ввести новые процедуры в мир лечения сердечно-сосудистых заболеваний. Одной из таких сложных процедур является чрескожное транскатетерное введение аортального клапана (TAVI), которое стало предпочтительной процедурой для пациентов с аортальным стенозом высокого хирургического риска. Было показано, что TAVI связан с повышенным риском сосудистых эмболий (частота 30-дневного инсульта колеблется от 2 до 5%). Точно так же аблация фибрилляции предсердий в настоящее время выполняется все чаще. Многие обсервационные исследования показали, что тихие инсульты вторичны по отношению к этим процедурам.
Следовательно, взвешивая риск сосудистых событий, связанных с этими вмешательствами, ожидается, что с развитием технологий, повышением квалификации и тщательным отбором пациентов эти процедуры должны стать более безопасными со временем. Примером модификации технологии для уменьшения инсульта является введение кругового катетера MER при абляции фибрилляции предсердий.
Новая пероральная антикоагулянтная терапия (NOAC)
Недавнее внедрение новых методов лечения пероральными антикоагулянтами (NOAC) предоставило больше возможностей для пациентов с неклапанной фибрилляцией предсердий. Основные преимущества NOAC заключаются в том, что эти агенты не требуют мониторинга, имеют быстрое начало действия и значительно снижают риск внутричерепного кровотечения по сравнению с пероральным антагонистом витамина K (VKA). Основные недостатки этих агентов заключаются в том, что их использование противопоказано при тяжелой почечной недостаточности и отсутствии антидота, чтобы обратить их действие, когда это необходимо. В дополнение к использованию NOAC в качестве хронической замены VKA, недавно исследование XVeRT показало, что пероральный ривароксабан можно безопасно использовать в качестве возможной альтернативы терапии VKA для предотвращения тромбоэмболических событий у пациентов, подвергающихся плановой кардиоверсии.
Предпринята попытка расширить использование NOAC для механических сердечных клапанов. Испытание дабигатрана по сравнению с варфарином у пациентов с механическими клапанами сердца было преждевременно прекращено после включения 252 пациентов из-за повышенного количества случаев тромбоэмболии и кровотечений среди пациентов в группе дабигатрана. Аналогичным образом, исследование RE-ALIGN было прекращено на раннем этапе из-за более высоких тромботических осложнений у пациентов с механическими сердечными клапанами, получавших дабигатран, по сравнению с пациентами, получавшими варфарин. Таким образом, до сих пор данные не подтверждают использование терапии NOAC у пациентов с механическими сердечными клапанами.
Источник
Макроскопический и органометрический анализ сердца в патологии (часть 2)
Макроскопический и органометрический анализ сердца в патологии : пособие для врачей / Л.Б. Митрофанова, Х.К. Аминева; под ред. проф. Г.Б. Ковальского. — Санкт-Петербург: ГПАБ, 1998. — 60 с.
В данном методическом пособии представлено детальное анатомическое описание сердца и обеспечивающих его нормальное функционирование систем с привлечением методов, адекватно оценивающих патологические изменения. Даны качественные, количественные параметры органа и его составных частей в соответствии с возрастом, полом и заболеваниями. В главе «Проводящая система сердца» изменения, возникающие в миокарде при электростимуляции изложены со ссылкой на методическое пособие тех же авторов «Номенклатура и атлас гистопатологии миокарда», СПб ГПАБ, 1994 г.
Пособие предназначено для патологоанатомов, судебно-медицинских экспертов, кардиологов и кардиохирургов
Городское патологоанатомическое бюро. Санкт-Петербург. 1998
библиографическое описание:
Макроскопический и органометрический анализ сердца в патологии (часть 2) / Митрофанова Л.Б., Аминева Х.К. — 1998.
код для вставки на форум:
ТРИКУСПИДАЛЬНЫЙ КЛАПАН
Трикуспидальный клапан (ТК) включаег в себя фиброзное кольцо, створки, хорды, папиллярные мышцы. Фиброзное кольцо замкнуто, контактирует с основанием некоронарной створки аорты и фиброзным кольцом митрального клапана. К нему крепятся мышечные пучки правого предсердия и желудочка, передняя, задняя и септальная створки. Иногда количество створок может достигать 6-7. Различают заднемедиальную, задне-латеральную и переднелатеральную комиссуры. Наибольшая створка — передняя, наименьшая — септальная. Створки имеют 3-слойное строение, как и в митральном клапане. Папиллярных мышц три, но может быть от 2 до 7. Каждая обычно имеет по 5-10 хорд, идущих к двум соседним створкам. Постоянной считается папиллярная мышца Ланчизи, расположенная на границе выходного тракта правого желудочка, от которого идут хорды к передней створке.
Трикуспидальный клапан, как и митральный, в силу анатомических особенностей нельзя рассматривать вне связи с предсердиями и желудочками. Изменение объема последних неминуемо сказывается и на клапанном аппарате, в частности, расширением фиброзного кольца с формированием относительной трикуспидальной недостаточности.
В норме у взрослых диаметр трикуспидального клапана -2,5-4,2 см, а периметр трикуспидального клапана — 11-12 см.
Изолированные приобретенные стенозы трикуспидального клапана практически не встречаются. В настоящее время все чаще и чаще наблюдаются инфекционные (септические) эндокардиты наркоманов — нестерильные внутривенные инъекции, приводят к деструктивному вальвулиту и трикуспидальной недостаточности. При ревматизме Трикуспидальный клапан поражается уже на фоне комбинированных пороков митрального и аортального клапанов. Наиболее частой формой является относительная недостаточность клапана, когда створки не изменены, а периметр фиброзного кольца более 12 см.
АОРТАЛЬНЫЙ КЛАПАН
Аортальный клапан состоит из луковицы аорты, фиброзного кольца и трех полулунных заслонок (рис. 11). В луковице аорты располагаются три углубления — синусы Вальсальвы: правый, левый и задний (некоронарный). В левом и правом синусах находятся устья соответствующих коронарных артерий. К нижним краям синусов крепятся заслонки клапана. У взрослых высота синусов от 1,7 до 2,0 см, ширина — 2,0-2,5 см, глубина -1,5-3,0 мм. Ширина синусов Вальсавы более 5 см является показанием для оперативного лечения. С возрастом синусы углубляются. Отношение диаметра восходящей аорты к луковице аорты в норме — 0,6-0,8 см. Увеличение индекса может свидетельствовать об аневризме восходящей аорты.
Рис. 11. Аортальный клапан
1 — стенка восходящего отдела аорты, 2 — некоронарный (задний) синус, 3 — правый коронарный синус, 4 — устье правой венечной артерии, 5 — правая створка, 6 — левый коронарный синус, 7 — устье левой венечной артерии, 8 — левая створка, 9 — левая некоронарно- коронарная комиссура, 10 — задняя створка, 11 — пространство Хенли
Фиброзное кольцо клапана состоит из коллагеновых волокон, соединяется с перепончатой частью межжелудочковой перегородки. У взрослых периметр клапана — 7,0 см, диаметр отверстия клапана — 2,0-2,3 см, площадь отверстия клапана — 2,5-3,0 см 2 , площадь створок — 4,0-5,0 см 2 . Гемодинамически значимый стеноз развивается при уменьшении площади отверстия клапана до 0,8-1,0 см. Для подбора искусственного протеза клапана измеряется не верхний, а нижний размер отверстия клапана, диаметр — на уровне основания заслонок.
Створки (правая, левая и задняя), как и в других клапанах, имеют слоистое строение. Свободный край каждой заслонки (створки) слегка удлинен и в центре имеет Аранциев узелок. Иногда в этой же зоне можно заметить щелевидные перфорации, идущие вдоль края, которые считают вариантами нормы. Заслонки разделяются комиссурами, под которыми находятся пространства Хенли. Соответственно свободному краю створок на стенке аорты различаются арочные гребни (рис. 12). Они замкнуты в виде арочного кольца. Аортальный клапан можно представить как комплекс створок и стенок синусов, фиксированных на жестком каркасе (рис. 13). Основная гемодинами-ческая нагрузка приходится на синусы, а полулунные заслонки лишь всплывают и опадают.
Рис. 12. Створка аортального клапана
1 — арочный гребень, 2 — Аранциев узелок, 3 — линия смыкания, 4 — свободный край, 5 — щелевидная перфорация
Наиболее частой причиной приобретенного порока аортального клапана считается ревматизм с формированием комбинированного порока сердца.
Выделяют три степени обызвествления аортального клапана при ревматизме:
- I степень — небольшое очаговое отложение кальция в толще комиссур или теле створок;
- II степень — грубый кальциноз створок и комиссур, не распространяющийся на область прикрепления створок;
- III степень — массивный кальциноз с переходом на фиброзное кольцо, стенку аорты и выходной отдел ЛЖ, переднюю створку митрального клапана.
Рис. 13. Луковица аорты
1 — синусы, 2 — арочное кольцо, 3 — сомкнутые створки
Недостаточность аортального клапана может развиться в результате инфекционного эндокардита, сифилиса, мезенхимальной дисплазии заслонок, выраженного атеросклероза луковицы и восходящей аорты, травмы. Нередко встречается и относительная недостаточность аортального клапана, которая обусловлена расширением фиброзного кольца. В таких случаях, кроме вышеописанных заболеваний, надо исключить синдром Элерса-Данлоса, болезнь Марфана с медионекрозом Гзеля-Эрдгейма, дисплазию аорты, атрофию медии аорты у пожилых субъектов.
Изолированный аортальный стеноз редко имеет ревматическую этиологию. Часто он обусловлен перенесенным раннее инфекционным эндокардитом либо кальцинозом врожденного двустворчатого клапана. При этом размеры двух створок клапанов могут быть одинаковы, одна из них имеет гребень ложной (заращенной) комиссуры, идущей в синусе от основания до свободного края, не стягивая заслонку (рис. 14 а, б). Врожденный двустворчатый клапан часто сочетается с коарктацией аорты, незаращенным аортальным протоком, дефектом межжелудочковой перегородки.
Аортальный стеноз у пожилых людей нередко сопровождается гастроинтестинальны-ми кровотечениями из эктазированных мезентериальных артерий. Расширение артерий связывают с дисплазией их стенок.
Отдельно рассматривают дегенеративный стеноз аортального клапана при дистрофической идиопатической кальцификации (в основном у пожилых людей). При данном заболевании подвижность заслонок ограничена конгломератами кальция, лежащими в фиброзном кольце, основании створок, достигая иногда линии смыкания, в синусах Вальсальвы. Сращения комиссур нет. Конгломераты кальция часто изъязвляются с образованием тромбов с последующими тробоэмболиями.
Атеросклеротический порок аортального клапана диагностируется в случае сочетания «наползающих» атероматозных, кальцинированных бляшек с луковицы и восходящей аорты на основания створок со стенозирующим атеросклерозом коронарных артерий.
С возрастом аортальный клапан, как и митральный, претерпевают изменения. Узелки Аранция увеличиваются, достигая 1,5-2,0 мм; линия смыкания становится выпуклой, створки у основания утолщаются, а у края истончаются и фенестрируются. Гистологически процесс старения клапана проявляется разрастанием коллагеновых и эластических волокон створок, прежде всего, в соприкасающихся точках и по линии изгиба. На этом этапе при световой микроскопии нередко видны скопления ксан-томных клеток. В дальнейшем развивается кальциноз базальных отделов створок и фиброзного кольца.
КЛАПАН ЛЕГОЧНОЙ АРТЕРИИ
Имеет три полулунные створки с узелками по свободному краю. Периметр устья у взрослых в среднем составляет 8 см, диаметр — 1,9-3,3 см. Приобретенные пороки клапана легочной артерии встречаются крайне редко.
В обозначении приобретенных или врожденных пороков сердца следует использовать классификацию ВОЗ:
- — комбинированный порок сердца — наличие стеноза и недостаточности одного клапана;
- — сочетанный порок сердца — наличие либо стеноза, либо недостаточности двух и более клапанов;
- — сложный порок сердца — наличие и стеноза, и недостаточности двух и более клапанов.
ОБЪЕМНЫЕ ИЗМЕРЕНИЯ ПОЛОСТЕЙ СЕРДЦА
Существует два метода измерения объемов камер сердца: прямой и непрямой (расчетное определение объема по формуле).
Прямой метод расчитан на заполнение полостей быстро твердеющими массами с последующим измерением объема вытесненной воды слепками желудочков и предсердий. Используют желатин, агар, каучук, резину, пластмассы. И.И.Медведев (1955) предлагал для лучшей фиксации сердца подвешивать его в коробке с последующей заливкой гипсом снаружи. По И.Д. Шперлингу (1983) полости сразу заливаются водой.
Заливка быстрозастывающими веществами — довольно кропотливая процедура. К тому же, при извлечении слепка часто возникают технические трудности из-за трабекулярного рельефа (особенно в правом желудочке). Процедура позволяет измерить истинный объем желудочков, но не рассчитана на заключение о сократительной способности миокарда.
Непрямой метод заключается в вычислении объема по размерам полости желудочка с использованием формулы конуса, эллипса, эллипсоида или параболоида. По формуле эллипсоида вычисляют объемы желудочков при эхокардиографичес-ком исследовании. А.М.Вихерт и соавт. (1974) для вычисления объемов измеряли окружность и площадь эндокарда желудочков, Е. A.Geiser, K.E.Bove (1974) — наружную окружность, высоту, толщину стенки желудочков, J.C.Lee et al (1975) — горизонтальные и вертикальные размеры полостей. Шведский инженер N.Sternbey рассчитал следующую формулу объема желудочка:
| V= | / <4Y 2 _ O 2 >/ | O 2 ,12π |
где Y — площадь желудочка, О — окружность желудочка.
На наш взгляд, целесообразно использовать метод А.В.Свищева (1983), который предлагает вычисление объемов полостей желудочков по более простой формуле конуса. Метод удобен в исполнении (выполняется после обычного вскрытия сердца по току крови), позволяет проводить адекватные клинико-анатомические сопоставления. Цель метода — выявление декомпенсации сократительной функции левого или правого желудочков, дилятации или сужения их полостей. Особенно показателен этот способ при начальных и скрытых формах миокарди-альной недостаточности, когда картина хронического венозного застоя стерта (кровотечение, желтуха и т.д.).
МЕТОД ИЗМЕРЕНИЯ ПОЛОСТЕЙ СЕРДЦА по Д.В.СВИЩЕВУ
1. По фиброзному кольцу измеряются периметры всех клапанов (рис. 15).
2. В каждом желудочке измеряется длина притока и оттока. Для правого желудочка длина притока — расстояние от фиброзного кольца трикуспидального клапана до внутренней верхушки правого желудочка, длина оттока — расстояние от внутренней верхушки желудочка до фиброзного кольца клапана легочной артерии. Для левого желудочка длина притока -расстояние от фиброзного кольца митрального клапана до внутренней верхушки желудочка, длина оттока — расстояние от внутренней верхушки желудочка до фиброзного кольца клапана аорты.
3. Полученные числа подставляются в формулу ,
где h — длина притока или оттока. Значения объема притока правого желудочка более 27 см 3 ; объема притока левого желудочка более 21 см 3 свидетельствуют о дилятации полостей (см. карту исследования сердца).
4. Вычисление резервного объема (разница между объемом притока и объемом оттока желудочка). Резервный объем (см. карту исследования сердца) эквивалентен остаточному объему, за счет которого сердце в момент повышенной функциональной нагрузки способно выбрасывать большее количество крови. В норме резервный объем правого желудочка (РОбП) — 10-11 см 3 , резервный объем левого желудочка (РОбЛ) — 9-10 см 3 Значения резервных объемов ниже указанных свидетельствуют о хронической декомпенсации сократительной функции миокарда того или иного желудочка.
Как показывает опыт, для диагностики хронической сердечной недостаточности наиболее точным, объективным показателем является отношение массы желудочка к его объему, то есть объемно-весовой показатель (ОВП), предложенный 30 лет назад А.Линцбахом.
5. Вычисление объемно-весового показателя выполняется по формуле:
| ОВП= | Масса желудочка Объем притока крови + объем оттока |
(см. карту исследования сердца). Значения ОВП правого желудочка (ОВПП) более 2,2 г/см 3 свидетельствуют о хронической недостаточности кровообращения по большому кругу, декомпенсации правого сердца. Значения ОВП левого желудочка (ОВПЛ) более 6 г/см 3 свидетельствуют о хронической сердечной недостаточности по малому кругу кровообращения, декомпенсации левого сердца.
РАЗДЕЛЬНОЕ ВЗВЕШИВАНИЕ ЧАСТЕЙ СЕРДЦА
Корректным способом установления степени и формы гипертрофии миокарда на макроскопическом уровне является раздельное взвешивание частей сердца (РВЧС), методику которого впервые предложил W.Muller (1883).
На наш взгляд, оптимальным из всех существующих модификаций РВЧС является метод А.М.Лифшица (1979), тем более что все нормативы, предлагаемые автором (см. приложение), статистически проверены на большой выборке и соответствуют современным запросам клиники.
Метод включает следующие этапы:
- Измерение периметров ПМЖА, ПА, ЛОА в самом узком месте проксимальной трети сосудов.
- Срезание эпикардиального жира и отсечение эпикардиальных и крупных сосудов.
- Отсечение свободных стенок желудочков от межжелудочковой перегородки параллельно межжелудочковой борозде (прижать браншу ножниц к межжелудочковой перегородке, вторая бранша перпендикулярна эпикарду) (рис. 16, 17).
Нормальные значения массы абсолютных весовых показателей частей сердца
| № | Масса | Норма (г) | ||||
| мужчины | женщины | |||||
| 1 | Эпикардиального жира с сосудами | До 95 | До 110 | |||
| 2 | Правого предсердия (ППс) | До 19 | До 19 | |||
| 3 | Левого предсердия (ЛПс) | До 18,5 | До 18,5 | |||
| 4 | Межпредсердной перегородки (МПП) | До 9 | До 9 | |||
| 5 | Свободной стенки левого желудочка (Л) | До 150 | До 117 | |||
| 6 | Свободной стенки правого желудочка (П) | До 75 | До 62 | |||
| 7 | Межжелудочковой перегородки (МП) | До 95 | До 65 | |||
| 8 | Общая масса сердца (МС) | До 405 | До 355 | |||
ОЦЕНКА ПОКАЗАТЕЛЕЙ РАЗДЕЛЬНОГО ВЗВЕШИВАНИЯ ЧАСТЕЙ СЕРДЦА
АБСОЛЮТНЫЕ ПОКАЗАТЕЛИ РВЧС
Масса сердца. Как уже отмечалось, это малоинформативный показатель, но может в определенной степени использоваться при дифференциальной диагностике. При массе сердца более 510 г следует дифференцировать: 1) врожденные и приобретенные пороки сердца и сосудов, 2) кардиомиопатии, 3) хронический миокардит, 4) «легочное сердце», 5) сочетанную патологию (одновременно наличие заболеваний почек, хронического бронхита, ИБС и т.п.).
При массе более 800 г следует дифференцировать: 1) аортальный стеноз, 2) амилоидоз сердца, 3) гипертрофическую кар-диомиопатию, 4) хронический миокардит.
При остром изолированном миокардите масса сердца обычно не более 405 г, при подостром — 406-510 г, а при хроническом более 510 г.
Масса сердца при алкогольной миокардиодистрофии («миокардиодистрофии тощих» — употреблении большого количества алкоголя низкого качества, в том числе суррогатов) практически никогда не превышает 405 г, а при алкогольной кардиомиопатии («миокардиодистрофии толстых» — употребление высококачественных напитков, высокий жизненный уровень, возможно, генетическая предрасположенность) она более 510г.
Следует учитывать, что показатель массы сердца в некоторых случаях может ввести патологоанатома в заблуждение. Так при ожирении III степени, когда масса тела достигает 180 кг и выше, сердце может весить 1 кг. В таких случаях, для исключения гипертрофии миокарда, вычисляется сердечный индекс -отношение массы сердца к массе тела (измеряется в единицах -г/кг — для мужчин до 5,7 г/кг, для женщин до 5,3 г/кг).
Масса предсердий. Объективный показатель для дифференциальной диагностики многих заболеваний. Масса правого предсердия является тонким индикатором начальной стадии развития легочной гипертензии.
При массе правого предсердия от 19 до 26,5 г (умеренная гипертрофия правого предсердия), следует дифференцировать:
1) гипертоническую болезнь, 2) ИБС, 3) заболевания почек с вторичной почечной гипертензией, 4) хронические заболевания бронхов и легких (начальная стадия легочной гипертензии), реже 5) миокардит, 6) кардиомиопатию.
При массе правого предсердия более 26,5 г (выраженная гипертрофия) следует дифференцировать: 1) мерцательную аритмию, 2) хронические неспецифическиё заболевания легких, 3) прекапиллярную легочную гипертензию, 4) пороки сердца с гиперволемией малого круга кровообращения, 5) миокардит, 6) кардиомиопатию.
При массе левого предсердия от 18,5 до 26,5 г (умеренная гипертрофия левого предсердия) следует дифференцировать:
1) гипертоническую болезнь, 2) ИБС, 3) вторичную почечную гипертензию, 4) хронические неспецифические заболевания легких, 5) миокардит, 6) кардиомиопатию.
При массе левого предсердия более 26,5 г (выраженная гипертрофия левого предсердия) дифференцировать: 1) посткапиллярную легочную гипертензию, 2) митральные пороки сердца, 3) миокардит, 4) кардиомиопатию.
Исследования последних десятилетий (Серов А.В., 1986, Сталиорайтите Е.И. и др., 1986, Draganov V. et al, 1987, GenoveseM. et al, 1984, Maruyarna Y., 1989) показали, что развитие гипертрофии миокарда при различной патологии сердца, включая миокардиты, кардиомиопатии, пороки сердца, гипертоническую болезнь, ИБС, хронические неспецифические заболевания легких, вторичную почечную гипертензию и другие, в силу анатомической и физиологической взаимосвязи мышечных волокон всех отделов сердца, в той или иной степени происходит во всех камерах сердца. По степени же выраженности гипертрофии миокарда того или иного отдела сердца можно диагностировать различную патологию. С этой целью мы используем термин «форма гипертрофии» (табл. 10), введенный А.М.Лифшицем (1984), которая определяется по соотношению сердечного индекса (СИ) и желудоч-кового индекса (отношение массы свободной стенки правого желудочка к массе свободной стенки левого желудочка; ЖИ).
Формы гипертрофии миокарда (желудочков)
| Формы гипертрофии | пол | Сердечный индекс | Желудочковый индекс | |||
|---|---|---|---|---|---|---|
| Гипертрофия правого желудочка | (абсолютные) | М | >или= 5,7 | >или= 0,67 | ||
| Ж | >или= 5,3 | >ил= 0,67 | ||||
| (относитель-ные) | М | или= 0,67 | ||||
| Ж | или= 0,67 | |||||
| Гипертрофия левого желудочка | (абсолютные) | М | >или=5,7 | или= 5,3 | или= 5,7 | 0,37-0,66 |
| Ж | >или= 5,3 | 0,38-0,66 | ||||
| Гипертрофии миокарда нет | М | 3,8-5,0 | 0,43-0,58 | |||
| Ж | 3,2-4,6 | 0,45-0,59 | ||||
| Изменения, пограничные с гипертрофией правого желудочка | М | 3,8-5,6 | 0,59-0,66 | |||
| Ж | 3,2-5,2 | 0,60-0,66 | ||||
| Изменения, пограничные с гипертрофией левого желудочка | М | 3,8-5,6 | 0,37-0,42 | |||
| Ж | 3,2-5,2 | 0,38-0,44 | ||||
| Изменения, пограничные с гипертрофией обоих желудочков | М | 5,1-5,6 | 0,43-0,58 | |||
| Ж | 4,7-5,2 | 0,45-0,59 | ||||
| Атрофия | М | 2 площади сосуда. Для его вычисления необходимо определить чистую массу сердца (миокарда): | ||||
МС — масса сердца,
где ЭЖ — масса эпикардиального жира с крупными сосудами.
Затем вычисляется суммарная площадь просвета артерий:
где L — периметр коронарной артерии (см. главу «Коронарные артерии»).
Индекс кровоснабжения миокарда определяется по формуле:
Например, масса сердца — 650 г, эпикардиального жира -50 г, периметр передней межжелудочковой артерии — 3 мм, левой огибающей артерии — 2 мм, правой артерии сердца — 10 мм.
Данный показатель — высокоинформативный индикатор ишемии миокарда. Его значения от 21,5 до 25 г/мм 2 соответствует стенокардии или стенокардитическому синдрому при кардиоми-опатии и миокардите. Значения от 25 до 39 г/мм 2 наблюдаются у лиц, перенесших инфаркт миокарда в прошлом. И, наконец, индекс кровоснабжения миокарда — 40 г/мм 2 и более свидетельствует об острой ишемической катастрофе — острой коронарной недостаточности или остром инфаркте миокарда.
Индекс эпикардиального жира (ИЭЖ) выявляет ожирение сердца (см. также главу «Перикард»). Вычисляется по формуле:
Таким образом, органометрия сердца, в том числе, РВЧС и объемные измерения его полостей в значительной мере объективизируют морфологический диагноз, позволяют проводить дифференциальную диагностику, дают дополнительную информацию о тяжести патологического процесса. Особенно важно, что патологоанатом, представляя количественную характеристику сердца, имеет возможность проводить клинико-анатомичес-кие сопоставления с учетом данных эхокардиографии, корона-рографии, компьютерной и магнитно-резонансной томографии, способствуя совершенствованию лечебно-диагностического процесса.
ПРОВОДЯЩАЯ СИСТЕМА СЕРДЦА
К компонентам проводящей системы относят синуснопред-сердный (синоаурикулярный узел, узел Keith-Flack), межузловые тракты, предсердно-желудочковый узел (атриовентрикуляр-ный узел, узел Aschotf-Towara), предсердно-желудочковый пучок His.
Синоаурикулярный узел (САУ) располагается в начальной части пограничной борозды (рис. 19), начинаясь в передней стенке верхней полой вены, узел определяется в виде островка более бледной, желтоватой ткани под эпикардом, с возрастом погружается вглубь стенки. Форма узла различна: описывают узел в форме репы, древовидную, веретенообразную и веерообразную формы. Целесообразно различать головную часть (расположена ближе к эпикарду, верхней полой вене), тело узла и хвостовую часть — простираются каудально и вглубь миокарда предсердия, вдоль пограничного гребня. Размеры САУ взрослого человека колеблются по длине от 10 до 18 мм (до 30 мм по данным некоторых авторов), ширина 2-5 мм, толщина 1-2 мм. Артерия САУ подходит к узлу, огибая верхнюю полую вену спереди (реже сзади), отходя от правой или левой огибающей артерии — это зависит от типа кровоснабжения сердца. Без специальных навыков выделить для исследования узел крайне сложно, проще исследовать его в гистологических препаратах. САУ, так же как и любой из элементов проводящей системы, окружен коллагено-выми волокнами, которые, внедряясь в ткань узла, разделяет его на пучки. Артерия САУ имеет непропорционально большой калибр и располагается либо среди пучков ткани САУ, либо рядом с ними, по границе с миокардом предсердия. Собственно ткань узла состоит из морфологически неоднородных клеток. Большие бледные клетки (pale, Р-клетки), содержат меньшее, по сравнению с сократительными миоцитами, количество мио-фибрилл, митохондрий, имеют округлую или овальную форму, непропорционально большое центрально расположенное ядро. Диаметр клеток 10-13 мм. В центре скопления Р-клеток располагается зона, составленная узловыми клетками (nodal, М-клет-ки) с синхронной электрической активностью, самым высоким уровнем автоматизма. Морфологически М-клетки имеют бледную цитоплазму, диаметр около 5 мкм. Периферия узла представлена переходными клетками (transitional, Т-клетки). Последние окрашены темнее N- или Т-клеток, но бледнее клеток сократительного миокарда, имеют удлиненную форму, но меньшие размеры, чем сократительные миоциты. Наконец, в состав узла входят мышечные предсердные клетки диаметром 16 мкм, цитоплазма их окрашена интенсивнее (темнее клеток узла).
Рис. 19. Строение проводящей системы сердца
1 — аорта, 2 — легочная артерия, 3 — ушко левого предсердия, 4 — верхняя полая вена, 5 -овальное окно, 6 — митральный клапан, 7 — трехстворчатый клапан, 8 — мембранозная часть межжелудочковой перегородки, 9 — мышечная часть межжелудочковой перегородки, 10 — синоаурикулярный узел, 11 — ат-риовентрикулярный узел, 12 — пучок Гиса, 13-пучок к левому предсердию, 14 — передний пучок к атриовентрикулярному узлу, 15 — задний пучок к атриовентрикулярному узлу, 16 — разветвления левой ножки пучка Гиса, 17 — разветвления правой ножки пучка Гиса
В отношении проведения межузловых импульсов (от САУ к АВУ) существует три концепции. Согласно одной из них, от си-нуснопредсердного узла импульс распространяется широким фронтом по миокарду предсердия до атриовентрикулярного узла. По второй — в определенных участках обеспечивается предпочтительное проведение импульсов, например, воздействие правильного, параллельного расположения в них клеток. Сторонники третьей концепции развивают представление о специализированных трактах межузлового и межпредсердного проведения. В рамках этих представлений существуют :
1. Латеральные пучки к правому ушку.
2. Передний горизонт — пучок Бахмана к левому ушку.
3. Задний горизонт — пучок Тандлера к левому предсердию и устьям легочных вен.
4. Верхние пучки Венкебаха-Тандлера к верхней полой вене.
5. Нижние пучки к нижней полой вене.
6. Межузловые пучки Бахмана.
7. Медиальные пучки к межвенозному пучку миокарда. На практике в аритмологической клинике выделяют нормальные пути проведения (рис. 19):
— пучок к левому предсердию;
— задний пучок к атриовентрикулярному узлу;
— передний пучок к атриовентрикулярному узлу. Предполагается, что в норме миокард предсердий и желудочков изолирован фиброзными образованиями основания сердца (фиброзные кольца, фиброзные треугольники, фиброзное тело) и сообщается только через посредство специфических проводящих путей, повреждения которых является причиной развития атриовентрикулярных блокад. Однако практика показала, что имеются дополнительные проводящие предсердно-желудочко-вые пути, по которым возбуждение достигает желудочков, минуя атриовентрикулярный узел. A.E.Kent (1913) описал такие пути в боковых стенках сердца. В дальнейшем, существование таких путей подтверждено не только морфологически (Anderson R., 1981), но и электрофизиологически. Существование и активация предсердно-желудочковых путей приводит к развитию желу-дочковой тахикардии, фибрилляций и требует оперативного вмешательства. Ввиду значительного разнообразия положения этих пучков в ходе хирургического лечения проводится картирование для локализации и разрушения аномальных пучков.
Аномальные мышечные пучки могут располагаться в любом участке предсердно-желудочковой борозды. На практике определяются следующие дополнительные предсердно-желудочко-вые пути проведения (рис. 20);
Рис. 20. Расположение аномальных (дополнительных) предсердно-желудочковых проводящих путей
1 — клапан легочной артерии, 2 — клапан аорты, 3 — митральный клапан, 4 — трехстворчатый клапан, 5 — передний фиброзный треугольник. Проводящие пути:
6 — задние септальные, 7 — передние сеп-тальные, 8 — задние парасептальные, 9 — латеральные
Задние септальные — над задним фиброзным треугольником, выше задней межжелудочковой борозды.
Передние септальные — в зоне центрального фиброзного тела.
Задние парасептальные — над задней четвертью фиброзных колец митрального и трехстворчатого клапанов.
Латеральные — над боковыми отделами фиброзных колец, в зоне тупого и острого края сердца.
Морфологический поиск аномальных проводящих путей трудоемок и требует определенного навыка: исследуется серия гистологических препаратов фиброзных колец, взятых вместе с эпикардом. Часто находят несмыкание фиброзных колец митраль-ного и (или) трикуспидального клапана, пучки мышечных волокон, идущие от предсердия к желудочку, которые могут быть расположены и в эпикардиальной клетчатке.
Атриовентрикулярный узел расположен на правом фиброзном треугольнике под эпикардом правого предсердия, выше перегородочной створки трехстворчатого клапана (рис. 21). Классическим ориентиром для обнаружения узла является треугольник: передне-верхняя стенка треугольника Коха образована сухожилием То-даро, нижняя стенка — фиброзным кольцом перегородочной створки трехстворчатого клапана, задне-верхняя стенка — устьем венечного синуса. Однако проекцию ат-риовентрикулярного узла на эпикард правого предсердия проще и точнее определять в треугольнике, образованном следующими ориентирами: нижний край венечного синуса, передняя комиссура трехстворчатого клапана, середина основания перегородочной створки трехстворчатого клапана (СиневА.Ф.,1981). Атриовентрикулярный узел и пучок располагаются на линии, идущей от нижнего края устья венечного синуса к передней комиссуре перегородочной створки трехстворчатого клапана (Михайлов С.С., 1987). Узел имеет вытянутую форму, длиной 5-15 мм, высотой 4-7 мм, толщиной до 1-2 мм, располагается под эпикардом на глубине 1-2 мм. Форма его может быть булавовидной, овальной, треугольной, неправильной. Гистологически в атриовентрикулярном узле различают периферическую, переходную и центральную части. Периферическая часть состоит из более светлых и несколько меньших клеток, чем сократительные. Центральная, компактная зона состоит из клеток меньшего размера, со светлой цитоплазмой, в которой мало миофибрилл и плохо определяется поперечная исчерчен-ность. Ядра их овальны. Расположены клетки беспорядочно, переплетаются. Среди узловых клеток рассеяны клетки, похожие на эндотелиальные. В атриовентрикулярном узле, по сравнению с синоаурикулярным, гораздо меньше эластических и коллагеновых волокон. Отчетливая соединительнотканная прослойка сопровождает артерию атриовентрикулярного узла. Эта артерия чаще всего (в 90% случаев) отходит в области креста сердца, в зависимости от типа кровоснабжения миокарда, от правой, реже, левой венечной артерии. В области пучка Гиса и его ножек эта артерия анастомозирует с передними перегородочными артериями, отходящими от передней межжелудочковой, иногда задней межжелудочковой артерии. Венозный отток происходит в переднюю межжелудочковую часть большой вены, частично в полость правого предсердия. В окружности узла можно обнаружить нервные ганглии, а в узле — нервные пучки. Соединитель-нотканный футляр узла переходит в футляр пучка, который прободает центральное фиброзное тело.
Предсердно-желудочковый пучок (пучок Гиса) длиной 6-20 мм, толщиной 1,5-2,0 мм, располагается под задним нижним краем перепончатой части межжелудочковой перегородки (рис. 21). Над гребнем межжелудочковой перегородки, на уровне правого синуса аорты, разделяется на левую и правую ножки. Пучок Гиса пересекается основанием перегородочной створки трехстворчатого клапана. Макроскопически пучок выглядит в виде тяжа серовато-белого цвета. Гистологически пучок Гиса не только окружен фиброзной соединительной тканью, но и разделен внутри на отдельные пучки. Клетки пучка Гиса продольно ориентированы, отличаются от клеток узла большим диаметром, не достигая, однако, размеров клеток сократительного миокарда. Левая ножка довольно хорошо определяется под эндокардом в верхней и средней трети. Ствол ножки разделяется на 2-4 ветви, одна из них направляется к передней сосочковой мышце, другая — к задней, оставшаяся — к верхушке сердца. Основные ветви разделяются, входят в трабекулярные мышцы и анастомо-зируют между собой. Правая ножка как бы продолжает пучок Гиса и прослеживается, как правило, до передней сосочковой мышцы правого желудочка. Чаще всего правая ножка разветвляется дистально. По мере продвижения от проксимальных к дисталь-ным участкам различия гистологического строения специализированного и сократительного миокарда нивелируются.
Атриовентрикулярный узел и пучок имеют непостоянные (дополнительные) проводящие пути. Из них наибольшее значение несут:
атриофасцикулярные — от САУ к пучку Гиса,
нодальновентрикулярные — от АВУ, минуя пучок Гиса к желудочкам,
фасцикуловентрикулярные — отходящие от пучка Гиса к желудочкам выше ножек.
Комплекс АВУ — пучок Гиса располагается близко к правому и левому предсердно-желудочковым клапанам, клапану аорты, перепончатой части межжелудочковой перегородки. Поэтому при хирургических вмешательствах с целью коррекции пороков сердца (протезирование клапанов, устранение дефекта межжелудочковой перегородки) возможно появление осложнений, связанных с повреждением проводяш.ей системы. В случаях клинических проявлений нарушения атриовентрикулярной проводимости необходимо после осмотра сердца, зон расположения АВУ и проводящих путей провести гистологическое исследование. Вырезается 3-4 кусочка, параллельных друг другу, в которых на сечении обнаруживают и исследуют морфологию атриовентри-кулярных образований. Окрашивание препаратов по ван Гизон облегчает ориентировку, четко выделяя фиброзные структуры.
Синоаурикулярный узел является центральным механизмом пейсмекерного комплекса. Функции АВУ сводятся: 1) к физиологической задержке импульсов, идущих от предсердия к желудочкам, чем достигается синхронизация фаз сокращения, 2) к фильтрации предсердных волн возбуждения, 3) к защите желудочков от преждевременного возбуждения (Кушаковский М.С., 1992).
ОСЛОЖНЕНИЯ ПРИ ЭЛЕКТРОСТИМУЛЯЦИИ СЕРДЦА
В связи с расширением возможностей и распространением использования электрокардиотерапии целесообразно остановиться на наиболее частых ее осложнениях. Электроимпульсная терапия (ЭИТ) проводится для восстановления ритма при та-хиаритмиях и брадикардиях, как правило, в экстренных ситуациях. ЭИТ подразделяется на дефибрилляцию и кардиоверсию (электрический импульс, синхронизированный с сердечным циклом). Выделяют трансторакальную (через грудную стенку), внутреннюю (непосредственно на сердце, обычно во время хирургических операций), чрезпищеводную и трансвенозную внутри-сердечную электроимпульсную терапию.
После ЭИТ на открытом сердце гистологически в миокарде обнаруживаются разрывы отдельных или нескольких рядом лежащих мышечных волокон, вокруг разрывов собираются сегментоядерные лейкоциты; в пограничных зонах выявляются сегмен-тарные и субсегментарные контрактуры (рис. 1.4-1.5 атласа), пятнистые кровоизлияния, чаще располагающиеся субэпикар-диально (рис. 4.6 атласа). При электроимпульсной терапии через грудную стенку на коже обнаруживаются следы электрода в виде поверхностных ожогов. В миокарде локальных изменений выявить не удается, встречаются лишь рассеянные очажки фрагментации мышечных волокон (рис. 3.5 атласа) и субсегментарные контрактуры (рис. 1.4.2 атласа). Многократные разряды сопровождаются нарастанием распространенности и тяжести повреждения миокарда, при этом улавливается связь скорее с кратностью, чем с величиной энергии импульса. Как проявление повреждения миокарда, может развиться отек легких.
В последние годы значительно чаще проводится хирургическое лечение тахиаритмий. В случаях нанесения разряда с целью разрушения добавочных атриовентрикулярных путей или ат-риовентрикулярного узла, в зоне воздействия обнаруживается коагуляционный некроз тканей. В таких случаях важно определить распространенность изменений, удостовериться в интакт-ности прилежащих к зоне воздействия структур (клапанов, крупных сосудов, гребня межжелудочковой перегородки), отсутствия перфорации. Некроз может сопровождаться небольшими зонами геморрагического пропитывания тканей, что не следует считать ятрогенией. Вокруг зоны некроза существует переходная (пери-фокальная) зона, в которой проявления повреждения тканей в виде дегидратации и контрактур миоцитов, отека стромы и инт-рацеллюлярного отека специализированных структур постепенно уменьшаются от центра к периферии. При удачном проведении деструкции перифокальная зона невелика — 1-4 мм, но имеет некоторые особенности строения. Если в перифокальной зоне ткань неоднородна, то к периферии обнаруживается усиление признаков повреждения; то есть соединительнотканные прослойки, сосуды и прочее как бы играют роль усиливающей линзы.
Морфологические проявления деструкции, проведенной электроразрядом, высокочастотным фокусированным УЗИ и радиочастотным излучением практически не различаются. Спустя месяц в зоне деструкции можно увидеть фиброзную ткань, липо-матоз.
Показания к установке искусственных водителей ритма к настоящему времени значительно расширены. Патологоанатомам приходится на вскрытии все чаще встречаться с необходимостью исключать осложнения временной и постоянной электростимуляции. При исследовании таких случаев необходимо исследовать положение кардиостимулятора, состояние тканей вокруг него, положение электродов. В документации зафиксировать положение и номер кардиостимулятора. Ни в коем случае нельзя выдергивать электроды, нужно их перерезать на уровне подключичной (или яремной) вены. Затем нужно убедиться в правильности расположения электрода. Чаще всего встречаются однокамерные электроды. В таких случаях кончик электрода должен быть фиксирован в миокарде в области верхушки правого желудочка. При соскальзывании электрод сдвигается током крови в артериальный конус в направлении устья легочной артерии. В случае расположения электрода выше апикальной трети правого желудочка электростимуляция может быть неполноценна. Двухкамерные кардиостимуляторы пока встречаются реже. В таких случаях один из электродов фиксируется к стенке правого предсердия.
Осложнения, встречающиеся при кардиостимуляции (по Витте И., 1995).
I. Интраоперационные осложнения:
- 1) асистолия, фибрилляция желудочков;
- 2) перфорация миокарда;
- 3) пневмоторакс, гидроторакс;
- 4) воздушная эмболия.
II. Послеоперационные осложнения:
- 1) первичное инфицирование ложа кардиостимулятора;
- 2) гематома ложа стимулятора;
- 3) пролежень, вторичное инфицирование кардиостимулятора;
- 4) сепсис;
- 5) стимуляция диафрагмы;
- 6) стимуляция грудных мышц.
III. Осложнения, обусловленные электродами:
- 1) дислокация электростимулятора;
- 2) повышение порога возбуждения миокарда;
- 3) нарушение детекции;
- 4) тромбозы вен;
- 5) переломы электрода;
- 6) нарушение изоляции, замыкание.
IV. Осложнения, обусловленные электростимулятором — большая группа осложнений, обусловленная техническими неполадками (в том числе, истощением источника питания; ошибками в его программировании). Морфологически можно выявить проявления синдрома малого выброса.
Наиболее часто встречающиеся нарушения ритма и проводимости: мерцательная аритмия, слабость синусового узла, синдром WPW, атриовентрикулярная блокада, желудочковые экстрасистолы, фибрилляция желудочков также поддаются морфологической диагностике, чему будет посвящено специальное пособие.
НОРМАТИВЫ ОРГАНОМЕТРИЧЕСКИХ ПОКАЗАТЕЛЕЙ СЕРДЦА
Показатели
Список литературы
- Автандилов Г. Г., Яблучанский Н.И., Салбиев К. Д., Непомнящих Л. М. Количественная морфология и математическое моделирование инфаркта миокарда.- Новосибирск: Наука, 1984.- 284 с.
- Беришвили И. И., Вахромеева М.Н., Лебедева Т.М. и др. Хирургическая анатомия субаортального конуса нормального сердца//Арх. анатом., гистол., эмбриол,- 1991,-Т. 100, N 4.- С. 44-53.
- Воробьев В.П., Синельников Г.Д. Атлас анатомии человек,- М:Медгиз, 1948.- Т.4, 381 с.
- Витте И. Практические рекомендации по имплантации электро-кардиостимуляторов//Состояние и перспективы развития электротерапии сердца.- Эрланген: Центральный институт биомед. техники, 1995.- С. 82-103.
- Гогин Е.Е. Болезни перикарда,- М.: Медицина, 1979.- 191 с.
- Константинов Б.А., Прелатов В.А., Иванов В.А. и др. Клапаносбе-регающие реконструктивные операции в хирургии пороков сердца.- М.: Медицина, 1989.- 139 с.
- Кушаковский М. С. Аритмии сердца,- Санкт-Петербург: Гиппократ, 1992.- 543 с.
- Лифшиц А.М. Патологоанатомическая оценка массы сердца по данным раздельного взвешивания его частей (Классификация и критерии гипертрофии и ожирения сердца). Метод, реком.- М., 1979.-23 с.
- Минкин Р.Б., Орлов А.В., Клемина И.К. и др. Метаболизм миокарда при экспериментальной уремии//Патологическая физиология и экспериментальная терапия.- 1985.- N З,- С. 28-30.
- Михайлов С.С. Клиническая анатомия сердца,- М.: Медицина, 1987.- 287 с.
- Орлов А.В. Состояние миокардапри хронической почечной недостаточности. (Клинико-экспериментальное исследование): Автореф. дис. . канд. мед. наук.- Л., 1986.- 16 с,
- Розенбврг В.Д., Непомнящих Л.М. Коронарография в патологической морфологии.- Новосибирск: Наука, 1987.- 243 с.
- СвищевА.В. Морфологическая характеристика сердца и периферических микрососудов при внезапной коронарной смерти: Автореф. дис. . канд. мед. наук.- М.: 1983.- 23 с.
- Синев А.Ф., Крымский Л.Д. Хирургическая анатомия проводящей системы сердца,- М.: Медицина, 1985.- 270 с.
- Синев А.Ф., Крымский Л.Д. Анатомические типы проводящей системы при врожденных пороках сердца //Кардиология,- 1986.- Т. 26, N 6.- С. 74-79.
- Нукабар А.В. Различия в строении проводящей системы сердца человека и их значение для электрокардиографии//Клин, мед.- 1987,-N 3- С. 85-88.
- Шперлинг И.Д. Функциогенная гипертрофия сердца человека в морфологическом освещении.- Ереван; Айастан, 1983.- 124с,
- Virmani R. et a/. Mitral valve prolapse//Human Pathology. — 1987.-Vol. 18, № 16, — P. 596-602.
Оглавление
Список сокращений. 3
Эпикардиальная жировая клетчатка. 7
ФОРМА И РАЗМЕРЫ СЕРДЦА. 7
КОРОНАРНЫЕ АРТЕРИИ. 10
ЛИМФАТИЧЕСКАЯ СИСТЕМА СЕРДЦА. 15
ИННЕРВАЦИЯ СЕРДЦА. 16
ВСКРЫТИЕ СЕРДЦА . 17
Осмотр частей и органометрия сердца. 18
- Правое предсердие . 18
- Левое предсердие . 19
- Правый желудочек . 21
- Левый желудочек . 22
- Клапанный аппарат сердца. 23
- Митральный клапан . 24
- Трикуспидальный клапан . 30
- Аортальный клапан . 31
- Клапан легочной артерии . 34
ОБЪЕМНЫЕ ИЗМЕРЕНИЯ ПОЛОСТЕЙ СЕРДЦА . 34
- Метод измерения полостей сердца по А. В. Свищеву . 35
РАЗДЕЛЬНОЕ ВЗВЕШИВАНИЕ ЧАСТЕЙ СЕРДЦА . 37
- Оценка показателей раздельного взвешивания частей сердца. 38
- Абсолютные показатели РВЧС . 38
- Относительные показатели РВЧС . 41
- Индекс кровоснабжения миокарда. 43
ПРОВОДЯЩАЯ СИСТЕМА СЕРДЦА. 45
ОСЛОЖНЕНИЯ ПРИ ЭЛЕКТРОСТИМУЛЯЦИИ СЕРДЦА . 50
Приложение 1. Нормативы органометрических показателей сердца . 53
Приложение 2. Карта исследования сердца . 54
Список литературы . 57
похожие статьи
Ложная посттравматическая аневризма бедра как причина смерти / Федченко Т.М., Дмитриева О.А., Боканович И.Б., Дмитриев М.О. // Медицинская экспертиза и право. — 2010. — №6. — С. 46-48.
Идентификация причин внезапной сердечной смерти при посредстве гистохимических методов исследования / Швалев В.Н., Гуски Г., Сосунов А.А. // Матер. IV Всеросс. съезда судебных медиков: тезисы докладов. — Владимир, 1996. — №2. — С. 29-31.
К вопросу о саморазрывах сердца / Кечек К.С. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 109-111.
Источник