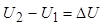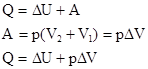- ЭНЕРГЕТИЧЕСКИЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- Энергетические эффекты химической реакции. Первый закон термодинамики.
- Энергетические эффекты химических реакций
- Энергетические эффекты химических реакций. Внутренняя энергия и энтальпия. Стандартная энтальпия образования вещества.
ЭНЕРГЕТИЧЕСКИЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Химические реакции сопровождаются выделением или поглощением теплоты – тепловыми эффектами Q (определяется количеством выделенной или поглощенной теплоты). Раздел химии, рассматривающий тепловые эффекты, называется термохимией. В термохимии используют термохимические уравнения реакций, в которых запись химической реакции производят с указанием теплового эффекта Q, а так как он зависит от агрегатного состояния, то – с указанием агрегатного состояния веществ. Реакции, при протекании которых выделяется теплота, называются экзотермическими. Тепловой эффект экзотермической реакции считается в термохимии положительным. Реакции, протекающие с поглощением теплоты, называются эндотермическими и их тепловой эффект отрицательный. Q обычно относят к 1 моль какого-либо вещества (обычно продукта реакции) и выражают в Дж. Поэтому стехиометрические коэффициенты при других веществах термохимического уравнения могут быть дробными.
Общий вид термохимических уравнений:
1) для экзотермической реакции
2) для эндотермической реакции
Основным законом термохимии является закон Гесса:
Тепловой эффект химической реакции зависит только от состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
Закон Гесса справедлив для любых химических процессов, сопровождающихся изменением энергии (химические реакции; растворение; кристаллизация и др.).
Закон Гесса открыт в период становления закона сохранения энергии (1 начала термодинамики). В соответствии с законом сохранения энергии – энергия не может возникнуть ниоткуда и исчезнуть бесследно, а только может переходить из одной формы в другую в строго эквивалентных соотношениях – для любого процесса соблюдается равенство:
где U – внутренняя энергия системы (включает кинетическую энергию движения частиц в системе), А – работа, выполняемая системой против всех сил, действующих на нее (внешнее давление, сила поверхностного натяжения и др.). U – это функция состояния системы; внутренняя энергия не зависит от пути перехода из начального в конечное состояние. Большинство химических реакций протекает при постоянном давлении. Для этого случая А = Р∙∆V = Р∙(V2 – V1), где V – объем.
Величина Н называется энтальпией.
Следовательно, изменение энтальпии продуктов реакции по сравнению с энтальпией исходных веществ в изобарном процессе (при Р=const) численно равно подведенному или выделившемуся количеству теплоты.
Для изохорного процесса (при постоянном объеме):
QV = ∆U, т.к. Р∙∆V = 0, т.е. тепловой эффект численно равен изменению внутренней энергии.
При термохимических расчетах широко используются два следствия из закона Гесса. Первое следствие связано с понятием теплоты (энтальпии) образования: ∆Нобр.— это теплота процесса образования 1 моль сложного вещества из простых веществ. Теплота образования простых веществ, устойчивых при 25 0 С и давлении 0,1 МПа, принята за ноль.
1 следствие из закона Гесса:
Тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом теплот образования исходных веществ (с учетом стехиометрических коэффициентов перед формулами веществ в уравнении реакции)
Теплоты образования многих веществ известны и сведены в таблицы. Однако для многих веществ они не могут быть определены экспериментально. Но можно определить теплоту сгорания. С теплотами сгорания веществ связано 2 следствие из закона Гесса. ∆Нсгор. – это теплота, выделяющаяся при сгорании в кислороде 1 моль вещества.
2 следствие из закона Гесса:
Тепловой эффект реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов реакции (с учетом стехиометрических коэффициентов)
Следствия из закона Гесса широко используются при термохимических расчетах, при этом используются справочные данные стандартных ∆Нобр. и ∆Нсгор. (стандартных, т.е. отнесенных к стандартным условиям: 25 0 С — температура и 0,1 МПа – давление).
Источник
Энергетические эффекты химической реакции. Первый закон термодинамики.



Реакции, при которых наблюдается выделение энергии, называются экзотермическими (Q>0).
Реакции, идущие с поглощением энергии, называются эндотермическими (Q
Энтальпия. Стандартные условия при определении энтальпии. Каким образом рассчитывается энтальпия в ходе химической реакции.
Энтальпия, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц. Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении. Энтальпия представляет собой сумму внутренней энергии и давления, умноженного на объем системы, и равна: H = U + pV, где p — давление в системе, V — объем системы. Чтобы подчеркнуть справедливость этой величины только для стандартных условий, в таблицах её обозначают следующим образом: ∆Н 0 298 Маленький «нолик» рядом с ∆Н по традиции символизирует некое стандартное состояние, а цифра 298 напоминает, что значения приведены для веществ при 25 оС (или 298 К). aA+bB=cCdH 0 х.р=c*dH 0 C-(a*dH 0 A+b*dH 0 B)
Закон Гесса. Привести пример определения энтальпии химической реакции.
Закон Гесса — тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы).
Источник
Энергетические эффекты химических реакций



Молекулы состоят из атомов. Возможны два вида молекул: содержащие одинаковые атомы и молекулы, содержащие два или более различных атомов. Эти два вида молекул имеют разные названия:
· элемент – состоит из атомов только одного вида;
· соединение, или сложное вещество, – состоит из двух или более различных атомов.
Один моль каждого индивидуального вещества обладает определенным теплосодержанием, равно как и определенной массой. Теплосодержаниеявляется мерой энергии, накапливаемой веществом при его образовании. Тепловой эффект химической реакцииравен разности между теплосодержанием продуктов ее реакции и теплосодержанием реагирующих веществ. Если теплосодержание реагирующих веществ больше, чем у продуктов реакции, то при такой химической реакции тепло выделяется, и она называется экзотермической.Если же теплосодержание продуктов реакции больше, чем у реагирующих веществ, то при реакции тепло поглощается, и такая реакция называется эндотермической.
Каждый атом обладает энергией, часть которой связана с электронами и часть – с ядром. Электроны в атоме обладают кинетической энергией, и поскольку они притягиваются ядром и отталкиваются друг от друга, то и потенциальной энергией. Алгебраическая сумма кинетической и потенциальной энергий и составляют энергию, необходимую для отрыва электрона от атомного ядра. Ядро же каждого атома – колоссальный источник энергии, которая связана с взаимодействием ядерных частиц – нуклонов. Так как атомные ядра при химических реакциях не испытывают изменений, энергия ядер не изменяется. Поэтому энергия ядер не входит в теплосодержание молекул.
При нагревании твердого вещества увеличивается кинетическая энергия колебательного движения молекул около мест, занимаемых ими в кристаллической решетке. С повышением температуры эти тепловые колебания все больше нарушают упорядоченное строение кристалла. Когда же такое хаотическое тепловое движение молекул становится слишком быстрым, кристаллическая решетка полностью разрушается. При температуре, выше которой кинетическая энергия частиц обусловливает столь быстрое хаотическое движение, что кристаллическая решетка больше не может оставаться устойчивой, происходит фазовый переход – плавление твердого вещества.
В жидкости каждая молекула обладает значительно большей свободой движения, особенно поступательного и вращательного. При нагревании жидкости молекулярное движение усиливается. Кинетическая энергия обуславливает хаотическое движение, приводящее к распределению молекул по возможно большему объему. Поэтому с ростом температуры по мере увеличения энергии движения все большее число молекул может удаляться из жидкой фазы туда, где потенциальная энергия минимальна. При этом происходит другой фазовый переход – испарение жидкости.
Если продолжать нагревать вещество, то наступит момент, когда кинетическая энергия колебательного, вращательного и поступательного движений по величине станет сравнима с энергией химических связей. Тогда молекулы начинают разрушаться. По этой причине на Солнце не обнаружены молекулы, содержащие более чем два атома: только самые простые, двухатомные молекулы. Температура на Солнце настолько высока (6000 К), что более сложные молекулы не могут существовать.
Если дальше продолжать нагревание, то в конце концов достигается температура, при которой кинетическая энергия настолько возрастает, что разрушаются ядра. Тогда начинаются ядерные реакции.
Источник
Энергетические эффекты химических реакций. Внутренняя энергия и энтальпия. Стандартная энтальпия образования вещества.
Химическая реакция – это процесс в ходе, которого из одних веществ образуются другие.




В ходе химических реакций происходит разрушение одних химических связей и образование других. На разрыв связи расходуется энергия, а при образовании – выделяется. В связи с этим любая химическая реакция сопровождается энергетическим эффектом. Т.е. выделением или поглощением энергии. Эта энергия может быть затрачена или получена в различных видах:
3. световой (электромагнитное излучение).
Задачами термохимической динамики являются:
1. определение физических эффектов химических реакций, в частности тепловых;
2. изменение свободной энергии системы с целью оценки возможности протекания данной реакции при данных условиях.
Основные понятия и законы в термодинамике.
Система – произвольно выбранная совокупность тел , находящаяся во взаимодействии. Основное свойство, которой является результат взаимодействия образующих ее частей.
Изолированная система –система, не обменивающаяся со средой ни веществом, ни энергией.Закрытая системаобменивается со средой энергией, но не обменивается веществом. Если закрытая система получает энергию, она положительна, если отдает – отрицательна. Открытая система обменивается со средой веществом и энергией. Закрытые и изолированные системы создаются человеком с определенными целями. Химические реакции, как правило проводят в закрытых системах. Состояние системы характеризуется параметрами состояния: давления, температуры, объема и компонентный состав, т.е. какие вещества и в каком количестве в системе присутствуют.
Внутренняя энергия системы (U) – это общий запас энергии системы, включающий энергию поступательного и вращательного движения молекулы, энергию внутримолекулярных колебаний атома, энергию движения электронов в атоме, внутриядерную энергию, т. е. все виды энергии кроме кинетической энергии движения системы как целого и его потенциальной энергии. Внутренняя энергия является функцией состояния системы, U(P,V,T, 
Процесс в ходе которого меняется хотя бы один из параметров называется термодинамическим процессом. И в ходе такого процесса изменяться внутренняя энергия системы P2,V1,T1, 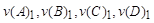
Изменение внутренней энергии не зависит от пути перехода системы из первого состояния во второе, а зависит только от начального (U1) и конечного (U2) значения внутренней энергии. Если закрытая система переходит из состояния 1 в состояние 2, она обменивается с внешней средой теплотой и механической энергией, затрачиваемой механической работой.
Закон сохранения энергии: теплота, подводимая к системе, затрачивается на изменение внутренней энергии и совершение работы, где работа, действующая против всех сил действующих на систему.
Тепловые эффекты химических реакций.
Если в закрытой термодинамической системе протекает химическая реакция 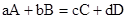
Тепловые эффекты реакции при постоянном объеме (Qv)
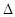
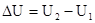
Если 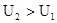
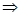
Если 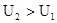
Дата добавления: 2015-08-08 ; просмотров: 5662 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник