- Двухатомная молекула
- Содержание
- Модели
- Интересные факты
- Примечания
- См. также
- Полезное
- Смотреть что такое «Двухатомная молекула» в других словарях:
- Двухатомные молекулы: характеристика и свойства
- Содержание:
- Двухатомные молекулы: характеристика и свойства
- Свойства двухатомных молекул
- Типы двухатомных молекул
- Список двухатомных молекул
- Двухатомная молекула
- Связанные понятия
- Двухатомная молекула
- Трансляционные энергии
- Вращательные энергии
- Колебательные энергии
- Сравнение интервалов вращательной и колебательной энергии
Двухатомная молекула
Двуха́томная моле́кула — молекула, составленная из двух атомов одного или разных элементов. Атомы связаны при помощи ковалентной связи.
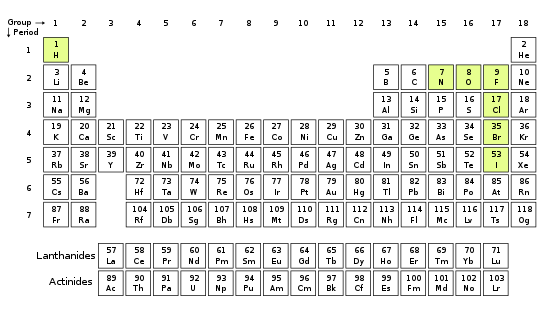
Всего восемь элементов могут существовать в виде двухатомных молекул:
Двухатомные молекулы образуют только газообразные при обычных условиях элементы (за исключением инертных газов). То же относится и ко многим другим элементам в парах при достаточно высоких температурах. [1]
Содержание
Модели
При квантово-механическом рассмотрении двухатомной молекулы, используются различные приближения для потенциальной энергии межатомного взаимодействия. Наиболее распространённые из них: потенциал Морзе и потенциал Пёшля — Теллера.
Известны гомоядерные двухатомные молекулы и гетероядерные двухатомные молекулы. Большой вклад в понимание электронной структуры и строение молекул внёс Г. Херцберг, лауреат Нобелевской премии по химии за 1971 год. [2] [3]
Интересные факты
- Земная атмосфера на 99 % состоит из двухатомных молекул — 21 % O2 и 78 % N2.
- Атомы кислорода также могут составлять озон — трехатомную молекулу O3
Примечания
- ↑Некрасов Б. В. Курс общей химии. — Издание 14-ое (стереотипное). — М .: Государственное издательство химической литературы, 1962. — 843 с.
- ↑Герцберг Г. Спектры и строение двухатомных молекул. — изд. иностранной литературы. — 1949.
- ↑Хьюбер К.-Н., Герцберг Г. Константы двухатомных молекул. — в 2-х частях:1, молекулы Ag-MoO. 2, молекулы N2-ZnO. — М .: «Мир», 1984.
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Двухатомная молекула» в других словарях:
двухатомная молекула — dviatomė molekulė statusas T sritis fizika atitikmenys: angl. diatomic molecule; two atom molecule vok. zweiatomiges Molekül, n rus. двухатомная молекула, f pranc. molécule diatomique, f … Fizikos terminų žodynas
Химическая связь — … Википедия
двуха́томный — ая, ое. Состоящий из двух атомов. Двухатомное соединение. Двухатомная молекула … Малый академический словарь
Абсолютно твёрдое тело — Абсолютно твёрдое тело второй опорный объект механики наряду с материальной точкой. Механика абсолютно твердого тела полностью сводима к механике материальных точек (с наложенными связями), но имеет собственное содержание (полезные понятия… … Википедия
Абсолютно твердое тело — Абсолютно твёрдое тело в механике механическая система, обладающая только поступательными и вращательными степенями свободы. «Твёрдость» означает, что тело не может быть деформировано, то есть телу нельзя передать никакой другой энергии, кроме… … Википедия
Молекулярный ион водорода — Молекулярный ион водорода простейшая двухатомная молекула H2+, образуется при ионизации молекулы водорода. В молекулярном ионе H2+ образуется одноэлектронная химическая связь с расстоянием dHH = 1,07Å. Одноэлектронная связь менее прочна… … Википедия
Межатомное взаимодействие — Вид вращающегося фуллерена C60. Межатомное воздействие электромагнитное взаимодействие электронов и ядра одного атома с электронами и ядром другого атома. Межато … Википедия
diatomic molecule — dviatomė molekulė statusas T sritis fizika atitikmenys: angl. diatomic molecule; two atom molecule vok. zweiatomiges Molekül, n rus. двухатомная молекула, f pranc. molécule diatomique, f … Fizikos terminų žodynas
dviatomė molekulė — statusas T sritis fizika atitikmenys: angl. diatomic molecule; two atom molecule vok. zweiatomiges Molekül, n rus. двухатомная молекула, f pranc. molécule diatomique, f … Fizikos terminų žodynas
molécule diatomique — dviatomė molekulė statusas T sritis fizika atitikmenys: angl. diatomic molecule; two atom molecule vok. zweiatomiges Molekül, n rus. двухатомная молекула, f pranc. molécule diatomique, f … Fizikos terminų žodynas
Источник
Двухатомные молекулы: характеристика и свойства
Содержание:
Двухатомные молекулы: характеристика и свойства
Двухатомные молекулы – молекулы, включающие два атома одного или разных элементов. Атомы в такой системе связаны между собой с помощью ковалентной полярной или неполярной связи.
Свойства двухатомных молекул
Важной характеристикой двухатомных молекул является кривая потенциальной энергии. При сближении двух атомов друг к другу возникает химическая связь, что отражается на потенциальной энергии. При образовании связи на кривой появляется минимум, характеризующий равновесное расстояние (re) между ядрами. Если химическая связь не образуется, то минимум на потенциальной кривой не появляется, хотя атомы взаимодействуют между собой.
Электронное состояние молекулы – это совокупность электронных состояний атомов. Движение электронов происходит в молекулярных пределах. При рассмотрении необходимо учитывать то, что некоторые электроны принадлежат молекуле, а некоторые – отдельным атомам. Это разделение важно брать во внимание при образовании ионных и ковалентных связей. В первом случае атомы с большей электроотрицательностью отдают свои электроны другим атомам. Таким образом формируются ионы с заполненными оболочками, между которыми действуют электростатические силы притяжения. Например, ионная связь образуется в молекуле поваренной соли NaCl.
Ионная и ковалентная связи – предельные случаи, которые могут действовать с большей или меньшей степенью точности. Есть предположение, что существуют промежуточные связи с различными степенями ковалентности и ионности. Координационные, водородные и ван-дер-ваальсовские связи обладают меньшей прочностью. Последние возникают благодаря взаимной поляризации молекул.
Типы двухатомных молекул
Двухатомные молекулы – электрические системы, которые состоят из двух положительно заряженных ядер и электронов, взаимодействующих друг с другом и с ядрами. Значения энергии электронов определяют электронные состояния всей молекулы. В зависимости от симметрии все двухатомные молекулы классифицируют на типы:
К первому виду относятся соединения из одних атомов – азот N2, водород Н2 и др. Второй вид включает разнородные атомы – соляная кислота HCl, углекислый газ СО2 и др. В гомоядерных системах образуется неполярная связь, в гетероядерных – полярная.
Список двухатомных молекул
При нормальных условиях двухатомные молекулы формируются только в газовом состоянии:
Подобные структуры также могут образовываться у галогенов при нагревании:
Двухатомные молекулы возникают и у других элементов при достаточно высоких температурах. Инертные газы не образуют такие структуры и при обычных условиях они представляют собой только один атом.
Атмосфера нашей планеты включает около 21 % кислорода О2 и 78 % азота N2. Воздух, которым дышит все живое, состоит из двухатомных молекул. Озон О3 вырабатывается из кислорода и защищает Землю от воздействия вредного ультрафиолетового излучения.
Источник
Двухатомная молекула
- Двуха́томная моле́кула — молекула, состоящая из двух атомов одного или разных элементов. Если двухатомная молекула состоит из двух атомов того же элемента, например, водород (H2) или азот (N2), тогда она называется гомоядерной. В другом случае, если двухатомная молекула состоит из двух атомов разных элементов, например, монооксид углерода (CO) или оксид азота(II) (NO), то она называется гетероядерной. Атомы двухатомной молекулы связаны при помощи ковалентной связи.
При стандартных условиях стабильные гомоядерные двухатомные молекулы образуются только газами (за исключением благородных газов, таких как гелий (He) или неон (Ne), которые при стандартных условиях являются одноатомными газами):
хлор Cl2При несколько более высоких температурах гомоядерные двухатомные молекулы также образуют галогены, например:
астат At2 (возможно нестабилен)То же относится и ко многим другим элементам в парах при достаточно высоких температурах.
Связанные понятия
В химии валентными электронами называют электроны, находящиеся на внешней (валентной) оболочке атома. Валентные электроны определяют поведение химического элемента в химических реакциях. Чем меньше валентных электронов имеет элемент, тем легче он отдаёт эти электроны (проявляет свойства восстановителя) в реакциях с другими элементами. И наоборот, чем больше валентных электронов содержится в атоме химического элемента, тем легче он приобретает электроны (проявляет свойства окислителя) в химических.
Источник
Двухатомная молекула
Двухатомные молекулы — это молекулы, состоящие всего из двух атомов одного или разных химических элементов . Приставка ди- греческого происхождения, что означает «два». Если двухатомная молекула состоит из двух атомов одного и того же элемента, например водорода (H 2 ) или кислорода (O 2 ), то она называется гомоядерной . В противном случае, если двухатомная молекула состоит из двух разных атомов, таких как оксид углерода (CO) или оксид азота (NO), молекула называется гетероядерной . Связь в гомоядерной двухатомной молекуле неполярна.
Единственными химическими элементами, которые образуют стабильные гомоядерные двухатомные молекулы при стандартной температуре и давлении (STP) (или типичных лабораторных условиях 1 бар и 25 ° C), являются газы водород (H 2 ), азот (N 2 ), кислород (O 2). ), фтор (F 2 ) и хлор (Cl 2 ). [1]
В благородных газах ( гелий , неон , аргон , криптон , ксенон и радон ) также являются газами при STP, но они одноатомные . Гомоядерные двухатомные газы и благородные газы вместе называются «элементарными газами» или «молекулярными газами», чтобы отличить их от других газов, которые представляют собой химические соединения . [2]
При немного повышенных температурах галогены бром (Br 2 ) и йод (I 2 ) также образуют двухатомные газы. [3] Все галогены наблюдались как двухатомные молекулы, за исключением астата и теннессина , количество которых не определено.
Другие элементы образуют двухатомные молекулы при испарении, но эти двухатомные частицы реполимеризуются при охлаждении. Нагревание («крекинг») элементарного фосфора дает дифосфор P 2 . Пары серы в основном представляют собой дисеру (S 2 ). Дилитий (Li 2 ) и динатрий (Na 2 ) [4] известны в газовой фазе. Дитольфрам (W 2 ) и димолибден (Mo 2 ) образуются с шестью связями в газовой фазе. Дирубидий (Rb 2 ) двухатомный.
Все остальные двухатомные молекулы представляют собой химические соединения двух разных элементов. Многие элементы могут объединяться в гетероядерные двухатомные молекулы, в зависимости от температуры и давления.
Многие бинарные соединения 1: 1 обычно не считаются двухатомными, поскольку они являются полимерными при комнатной температуре, но при испарении они образуют двухатомные молекулы, например газообразный MgO, SiO и многие другие.
Сотни двухатомных молекул были идентифицированы [5] в окружающей среде Земли, в лаборатории и в межзвездном пространстве . Около 99% атмосферы Земли состоит из двух видов двухатомных молекул: азота (78%) и кислорода (21%). Естественное содержание водорода (H 2 ) в атмосфере Земли составляет всего лишь несколько частей на миллион, но H 2 является самой распространенной двухатомной молекулой во Вселенной. В межзвездной среде преобладают атомы водорода.
Все двухатомные молекулы линейны и характеризуются одним параметром, которым является длина связи или расстояние между двумя атомами. Двухатомный азот имеет тройную связь, двухатомный кислород — двойную связь, а двухатомный водород, фтор, хлор, йод и бром — все имеют одинарные связи. [6]
Двухатомные элементы сыграли важную роль в разъяснении концепций элемента, атома и молекулы в 19 веке, потому что некоторые из наиболее распространенных элементов, такие как водород, кислород и азот, встречаются в виде двухатомных молекул. Первоначальная атомная гипотеза Джона Дальтона предполагала, что все элементы одноатомны и что атомы в соединениях обычно имеют простейшие атомные отношения друг к другу. Например, Дальтон предположил, что формула воды представляет собой HO, давая атомный вес кислорода в восемь раз больше, чем у водорода [7], вместо современного значения, равного примерно 16. Как следствие, существовала путаница в отношении атомных весов и молекулярных формул примерно в течение полвека.
Еще в 1805 году Гей-Люссак и фон Гумбольдт показали, что вода состоит из двух объемов водорода и одного объема кислорода, а к 1811 году Амедео Авогадро пришел к правильной интерпретации состава воды, основанной на том, что сейчас называется законом Авогадро. и предположение о двухатомных элементарных молекулах. Однако эти результаты в основном игнорировались до 1860 года, отчасти из-за веры в то, что атомы одного элемента не будут иметь химического сродства к атомам того же элемента, а также отчасти из-за очевидных исключений из закона Авогадро, которые не были объяснены до более поздних сроков. диссоциирующих молекул.
На Конгрессе по атомным весам в Карлсруэ 1860 года Канниццаро возродил идеи Авогадро и использовал их для создания согласованной таблицы атомных весов, которая в основном соответствует современным значениям. Эти веса были важной предпосылкой для открытия периодического закона со стороны Дмитрия Менделеева и Лотара Мейера . [8]
Двухатомные молекулы обычно находятся в самом низком или основном состоянии, которое обычно также известно как Икс <\ displaystyle X> 



В квантовой теории электронное состояние двухатомной молекулы представлено символом молекулярного члена
2 S + 1 Λ ( v ) <\ Displaystyle ^ <2s + 1>\ Lambda (v)>
| Состояние | Энергия [а] ( Т 0 <\ displaystyle T_ <0>>  , см −1 ) , см −1 ) |
|---|---|
Икс 1 Σ грамм + <\ Displaystyle X ^ <1>\ Sigma _  | 0,0 |
А 3 Σ ты + <\ displaystyle A ^ <3>\ Sigma _ ^ <+>>  | 49754,8 |
B 3 Π грамм <\ displaystyle B ^ <3>\ Pi _  | 59306,8 |
W 3 Δ ты <\ displaystyle W ^ <3>\ Delta _ >  | 59380,2 |
B ′ 3 Σ ты — <\ displaystyle B '^ <3>\ Sigma _ ^ <->>  | 65851,3 |
а ′ 1 Σ ты — <\ displaystyle a '^ <1>\ Sigma _ ^ <->>  | 67739,3 |
а 1 Π грамм <\ displaystyle a ^ <1>\ Pi _  | 68951,2 |
ш 1 Δ ты <\ displaystyle w ^ <1>\ Delta _ >  | 71698,4 |
- ^ Единицы «энергии» здесь на самом деле являются обратной величиной длины волны фотона, испускаемого при переходе в состояние с наименьшей энергией. Фактическая энергия может быть найдена умножением данной статистики на произведение c (скорости света) и h (постоянной Планка); то есть примерно 1,99 × 10 -25 Джоуль-метров, а затем умножение на дополнительный коэффициент 100 для преобразования из см -1 в м -1 .
Вышеупомянутая флуоресценция возникает в различных областях электромагнитного спектра , называемых « полосами излучения »: каждая полоса соответствует определенному переходу от более высокого электронного состояния и колебательного уровня к более низкому электронному состоянию и колебательному уровню (как правило, в возбужденный газ из двухатомных молекул). Например, N 2 А <\ displaystyle A> 









Символ молекулярного члена — это сокращенное выражение угловых моментов, которые характеризуют электронные квантовые состояния двухатомной молекулы, которые также являются собственными состояниями электронного молекулярного гамильтониана . Также удобно и распространено представление двухатомной молекулы в виде двухточечных масс, соединенных безмассовой пружиной. Энергии, участвующие в различных движениях молекулы, можно разделить на три категории: поступательные, вращательные и колебательные энергии.
Трансляционные энергии
Поступательная энергия молекулы определяется выражением кинетической энергии :
E транс знак равно 1 2 м v 2 <\ displaystyle E _ <\ text
Вращательные энергии
Классически кинетическая энергия вращения равна
E гнить знак равно L 2 2 я <\ displaystyle E _ <\ text 


Для микроскопических систем атомного уровня, таких как молекула, угловой момент может иметь только определенные дискретные значения, задаваемые формулой
L 2 знак равно ℓ ( ℓ + 1 ) ℏ 2 <\ Displaystyle L ^ <2>= \ ell (\ ell +1) \ hbar ^ <2>\,> 


Кроме того, для двухатомной молекулы момент инерции равен
я знак равно μ р 0 2 <\ displaystyle I = \ mu r_ <0>^ <2>\,> 


Итак, подставляя угловой момент и момент инерции в E rot , уровни энергии вращения двухатомной молекулы задаются следующим образом:
E гнить знак равно л ( л + 1 ) ℏ 2 2 μ р 0 2 л знак равно 0 , 1 , 2 , . . . <\ displaystyle E _ <\ text
Колебательные энергии
Другой тип движения двухатомной молекулы для каждого атома вибрировать или вибрируют -along линии , соединяющей два атома. Колебательная энергия примерно такая же, как у квантового гармонического осциллятора :
E виб знак равно ( п + 1 2 ) ℏ ω п знак равно 0 , 1 , 2 , . . . . <\ displaystyle E _ <\ text 



Сравнение интервалов вращательной и колебательной энергии
Расстояние и энергия типичного спектроскопического перехода между уровнями колебательной энергии примерно в 100 раз больше, чем у типичного перехода между уровнями вращательной энергии .
В хороших квантовых числах для двухатомной молекулы, а также хорошие приближения вращательных уровней энергии, могут быть получены путем моделирования молекулы , используя случаи Хунда .
Мнемоника BrINClHOF , произносится как «Brinklehof», [12] HONClBrIF , произносится как «Honkelbrif», [13] и HOFBrINCl , произносится как «Hofbrinkle», была придумана, чтобы помочь вспомнить список диатомовых элементов. Другой метод для англоговорящих — это предложение: « Never Have Fear of Ice Cold Beer » как представление азота, водорода, фтора, кислорода, йода, хлора, брома.
Источник