- Что такое более полярная химическая связь?
- Ковалентная связь: полярная, неполярная, механизмы ее появления
- Определение и характеристика
- Типы связи
- Неполярная связь
- Полярная связь
- Как определить связь
- Видео
- Автор: Павел Чайка, главный редактор журнала Познавайка
- Ковалентная связь, полярная и неполярная, особенности, формулы и схемы
- Появления термина
- Виды ковалентной связи
- Ковалентная полярная — образование
- Ковалентная неполярная, разница между полярной и неполярной
- Свойства связи
- Что значит более полярная ковалентная связь
Что такое более полярная химическая связь?
вот реально умиляет дебилизм, другого слова не скажешь, тупо списать из какой-нибудь википедии, самое забавное, что совсем не по теме. )
отвечу кратко и по-существу: более полярная — значит больше дипольный момент. дипольный момент связи = (разность зарядов) *(расстояние между центрами атомов) .
примеры:
1. связь H-F более полярна чем H-O (в молекуле воды, например) потому как в первую очередь выше разность зарядов на атомах.
2. связь H-S в молекуле H2S менее полярна чем та же H-O в молекуле воды (несмотря на бОльший размер молекулы) , потому как разность зарядов (она в некоторой степени, по крайней мере качественно, следует из разности электроотрицательностей) на атомах существенно меньше.
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Термин ковалентная связь был впервые введён лауреатом Нобелевской премии Ирвингом Ленгмюром в 1919 году [1][2]. Этот термин относился к химической связи, обусловленной совместным обладанием электронами, в отличие от металлической связи, в которой электроны были свободными, или от ионной связи, в которой один из атомов отдавал электрон и становился катионом, а другой атом принимал электрон и становился анионом.
Позднее (1927 год) Ф. Лондон и В. Гайтлер на примере молекулы водорода дали первое описание ковалентной связи с точки зрения квантовой механики.
С учётом статистической интерпретации волновой функции М. Борна плотность вероятности нахождения связывающих электронов концентрируется в пространстве между ядрами молекулы (рис. 1). В теории отталкивания электронных пар рассматриваются геометрические размеры этих пар. Так, для элементов каждого периода существует некоторый средний радиус электронной пары (Å):
0,6 для элементов вплоть до неона; 0,75 для элементов вплоть до аргона; 0,75 для элементов вплоть до криптона и 0,8 для элементов вплоть до ксенона. [3]
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Источник
Ковалентная связь: полярная, неполярная, механизмы ее появления
Содержание:
Определение и характеристика
Сам термин «ковалентная связь» происходит от двух латинских слов: «со» – совместно и «vales» – имеющий силу, так как это связь происходящая за счет пары электронов, принадлежащей одновременно обоим атомам (или говоря более простым языком, связь между атомами за счет пары электронов, являющихся общими для них). Образование ковалентной связи происходит исключительно среди атомов неметаллов, причем появляться она может как в атомах молекул, так и кристаллов.
Впервые ковалентная химическая связь была обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, идеи, лишь затем была подтверждена экспериментально. Что же выяснили химики по ее поводу? А то, что электроотрицательность неметаллов бывает довольно большой и при химическом взаимодействии двух атомов перенос электронов от одного к другому может быть невозможным, именно в этот момент и происходит объединение электронов обоих атомов, между ними возникает самая настоящая ковалентная связь атомов.
Типы связи
В целом есть два типа ковалентной связи:
При обменном типе ковалентной связи между атомами каждый из соединяющихся атомов представляет на образование электронной связи по одному неспареному электрону. При этом электроны эти должны иметь противоположные заряды (спины).
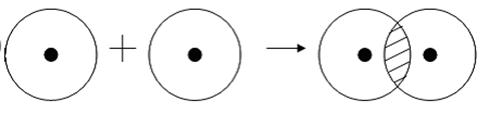
Примером подобной ковалентной связи могут быть связи происходящие молекуле водорода. Когда атомы водорода сближаются, в их электронные облака проникают друг в друга, в науке это называется перекрыванием электронных облаков. Как следствие, электронная плотность между ядрами увеличивается, сами они притягиваются друг к другу, а энергия системы уменьшается. Тем не менее, при слишком близком приближении ядра начинают отталкиваться, и таким образом возникает некое оптимально расстояние между ними.
Более наглядно это показано на картинке.
Что же касается донорно-акцепторного типа ковалентной связи, то он происходит когда одна частица, в данном случае донор, представляет для связи свою электронную пару, а вторая, акцептор – свободную орбиталь.
Также говоря о типах ковалентной связи можно выделить неполярную и полярную ковалентные связи, более подробно о них мы напишем ниже.
Неполярная связь
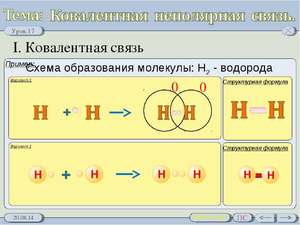
Определение ковалентной неполярной связи просто, это связь, которая образуется между двумя одинаковыми атомами. Пример образование неполярной ковалентной связи смотрите ниже на схеме.
Схема ковалентной неполярной связи.
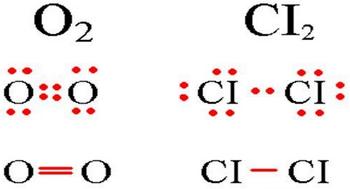
В молекулах при ковалентной неполярной связи общие электронные пары располагаются на равных расстояниях от ядер атомов. Например, в молекуле кислорода (на схеме выше), атомы приобретают восьми электронную конфигурацию, при этом они имеют четыре общие пары электронов.
Веществами с ковалентной неполярной связью обычно являются газы, жидкости или сравнительно низкоплавные тверды вещества.
Полярная связь
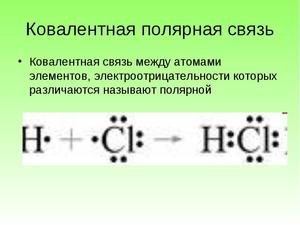
Теперь же ответим на вопрос какая связь ковалентная полярная. Итак, ковалентная полярная связь образуется, когда ковалентно связанные атомы имеют разную электроотрицательность, и обобществленые электроны не принадлежат в равной степени двум атомам. Большую часть времени обобществленые электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там обобществленые электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода. А все дело в том, что электроотрицательность у хлора больше чем у водорода.
Так выглядит схема ковалентной полярной связи.
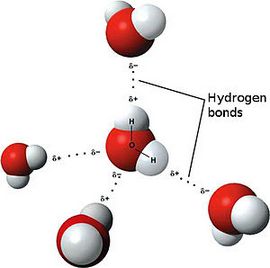
Ярким примером вещества с полярной ковалентной связью является вода.
Как определить связь
Что же, теперь вы знаете ответ на вопрос как определить ковалентную полярную связь, и как неполярную, для этого достаточно знать свойства и химическую формулу молекул, если эта молекула состоит из атомов разных элементов, то связь будет полярной, если из одного элемента, то неполярной. Также важно помнить, что ковалентные связи в целом могут возникать только среди неметаллов, это обусловлено самим механизмом ковалентных связей, описанным выше.
Видео
И в завершение видео лекция о теме нашей статьи, ковалентной связи.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Covalent Bond.
Источник
Ковалентная связь, полярная и неполярная, особенности, формулы и схемы
Можно сделать вывод, что химию знать просто необходимо, разбираться в ней и знать, как устроен наш мир или какие-то отдельные его части — интересно, и, более того, полезно.
Сейчас нам предстоит разобраться с таким термином, как ковалентная связь, которая, кстати говоря, может быть как полярной, так и неполярной. Кстати говоря, само слово «ковалентная», образуется от латинского «co» — совместно и «vales» — имеющий силу.
Появления термина
Начнём с того, что сам термин «ковалентная» впервые ввёл в 1919 году Ирвинг Ленгмюр — лауреат Нобелевской премии. Понятие «ковалентной» предполагает химическую связь, при которой оба атома обладают электронами, что называется совместным обладанием. Таким образом, она, к примеру, отличается от металлической, в которой электроны свободны, или же от ионной, где и вовсе один отдаёт электроны другому. Нужно заметить, что образуется она между неметаллами.
Исходя из вышесказанного, можно сделать небольшой вывод о том, что из себя представляет этот процесс. Она возникает между атомами за счёт образования общих электронных пар, причём пары эти возникают на внешних и предвнешних подуровнях электронов.
Примеры, вещества с полярной:
Виды ковалентной связи
Также различаются два вида — это полярная, и, соответственно, неполярная связи. Особенности каждой из них мы разберём отдельно.
Ковалентная полярная — образование
Что из себя представляет термин «полярная»?

В итоге при полярной электронная плотность смещается к более электроотрицательному, на нём же возникает частичный отрицательный заряд. В свою очередь, у того ядра, чья электроотрицательность ниже, возникает, соответственно, частичный положительный заряд.
Делаем вывод: полярная возникает между различными неметаллами, которые отличаются по значению электроотрицательности, а электроны располагаются ближе к ядру с большей электроотрицательностью.
Электроотрицательность — способность одних атомов притягивать к себе электроны других, тем самым образуя химическую реакцию.
Примеры ковалентной полярной, вещества с ковалентной полярной связью:
Формула вещества с ковалентной полярной связью
Ковалентная неполярная, разница между полярной и неполярной
И наконец, неполярная, скоро мы узнаем что же она из себя представляет.
Основное отличие неполярной от полярной — это симметрия. Если в случае с полярной электроны располагались ближе к одному атому, то при неполярной связи, электроны располагаются симметрично, то есть в равной степени по отношению к обоим.
Примечательно, что неполярная возникает между атомами неметалла одного химического элемента.
К примеру, вещества с неполярной ковалентной связью:
Также совокупность электронов зачастую называют просто электронным облаком, исходя из этого делаем вывод, что электронное облако связи, которое образует общая пара электронов, распределяется в пространстве симметрично, или же равномерно по отношению к ядрам обоих.
Примеры ковалентной неполярной связи и схема образования ковалентной неполярной связи
Свойства связи
Длина — расстояние между ядрами атомов, которые её образуют.
- Энергия — количество энергии, необходимой для её разрыва.
- Насыщаемость — способность атомов н-ное определённое количество связей.
Но Также полезно знать, как же различать ковалентную полярную и неполярную.
Ковалентная неполярная — это всегда атомы одного и того же вещества. H2. CL2.
В остальных случаях можно считать полярной.
На этом статья подошла к концу, теперь мы знаем, что из себя представляет этот химический процесс, умеем определять его и его разновидности, знаем формулы образования веществ, и в целом чуточку больше о нашем сложном мире, успехов в химии и образовании новых формул.
Источник
Что значит более полярная ковалентная связь
3.2.5 Полярная и неполярная ковалентная связь. Ионная связь
Если двухатомная молекула состоит из атомов одного элемента, то электронное облако распределяется в пространстве симметрично относительно ядер атомов. Такая ковалентная связь называется неполярной. Если ковалентная связь образуется между атомами различных элементов, то общее электронное облако смещено в сторону одного из атомов. В этом случае ковалентная связь является полярной. Как указывалось в разделе 3.1.4, для оценки способности атома притягивать к себе общую электронную пару используют величину электроотрицательности .
В результате образования полярной ковалентной связи более электроотрицательный атом приобретает частичный отрицательный заряд, а атом с меньшей электроотрицательностью – частичный положительный заряд. Эти заряды принято называть эффективными зарядами атомов в молекуле. Они могут иметь дробную величину. Например, в молекуле H С l эффективный заряд равен 0,17e (где е – заряд электрона Заряд электрона равен 1,602 . 10 -19 Кл. ):
H q+ Cl q – q=0,17 e
Система из двух равных по величине, но противоположных по знаку зарядов, расположенных на определенном расстоянии друг от друга, называется электрическим диполем. Очевидно, что полярная молекула является микроскопическим диполем. Хотя суммарный заряд диполя равен нулю, в окружающем его пространстве существует электрическое поле, напряженность которого пропорциональна дипольному моменту μ :

В системе СИ дипольный момент измеряется в Кл · м, но обычно для полярных молекул в качестве единицы измерения используется дебай (единица названа в честь П. Дебая) :
1 D = 3,33 · 10 –30 Кл · м
Дипольный момент служит количественной мерой полярности молекулы. Для многоатомных молекул дипольный момент представляет собой векторную сумму дипольных моментов химических связей. Поэтому, если молекула симметрична, то она может быть неполярной, даже если каждая из ее связей обладает значительным дипольным моментом. Например, в плоской молекуле BF3 или в линейной молекуле BeCl2 сумма дипольных моментов связей равна нулю:
Аналогично, нулевой дипольный момент имеют тетраэдрические молекулы CH4 и CBr4. Однако, нарушение симметрии, например в молекуле BF2Cl, обусловливает дипольный момент, отличный от нуля.
Источник

 Длина — расстояние между ядрами атомов, которые её образуют.
Длина — расстояние между ядрами атомов, которые её образуют.



