Электроотрицательность
Между атомами в молекуле образуется определенная химическая связь, которую в современном научном мире описывает квантовая механика. Заряженные частицы в атоме взаимодействуют между собой, обеспечивая молекуле определенную устойчивость.
В зависимости от расстояния между атомами, полярности и прочности, химическая связь между атомами может быть:
- ковалентная полярная,
- ковалентная неполярная,
- ионная,
- металлическая.
В 1932 году ученый-химик американского происхождения Лайнус Карл Поллинг ввел термин электроотрицательность. С помощью термохимических данных он определил, что энергия гетероядерной связи практически всегда больше, чем энергия гомоядерной связи.
Электроотрицательность — это способность атома в молекуле смещать к себе общие электронные пары. Она является необходимым показателем для описания молекулярных систем, определения типа связей в молекуле, распределения ионного заряда между взаимодействующими элементами. К факторам, которые влияют на эту величину, относятся: валентное состояние атома, степень окисления, координационное число и другие.
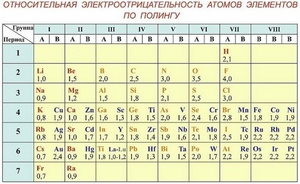
Приняв значение электроотрицательности водорода равной 2.1 произвольно и используя известные термодинамические данные, сравнивая электроотрицательность элементов с водородом, Поллинг составил первую шкалу относительных атомных электроотрицательностей.
Необходимо помнить, что электроотрицательность — величина не постоянная, а относительная, и позволяет лишь определить, в сторону какого элемента сдвигается общая электронная пара.
Помимо шкалы Поллинга, что изучают в школьном курсе химии, и которую можно найти на странице 276 учебника «Химия 8 класс» под редакцией В.В.Еремина, в мире существует около двадцати шкал определения электроотрицательности.
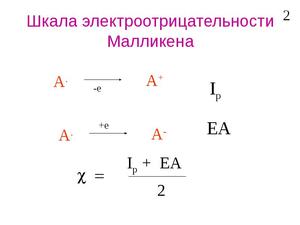
- Шкала Малликена. Она учитывает энергию, необходимую для превращения атома в ион или энергию ионизации, и количество энергии, выделяющееся при соединении электрона с атомом, или сродство к электрону.
Таблица электроотрицательности Поллинга — справочный материал, и не всегда есть под рукой. Однако существуют общие закономерности электроотрицательности, и, зная расположение элемента в Периодической системе Д.И.Менделеева, можно косвенно оценить, в сторону какого из элементов в молекуле будет сдвигаться общая электронная пара.
Электроотрицательность химических элементов, расположенных правее, больше, чем у элементов, расположенных левее в одном периоде. Электроотрицательность элементов, расположенных выше, больше, чем у элементов, расположенных ниже в одной группе. Исходя из этих данных, самый высокий показатель у элементов, расположенных в правом верхнем углу, и самый низкий у элементов внизу слева.
По этим данным был составлен ряд электроотрицательности, в котором химические элементы расположены в порядке убывания ее величины: F, O, N, Cl, Br, S, C, P, H, Si, Mg, Li, Na.
Если таблица Поллинга под рукой, с помощью несложных арифметических действий можно определить тип связи в молекуле. Для этого нужно найти относительную электроотрицательность атомов, входящих в молекулу по таблице, и из большего значения вычесть меньшее, а по результату оценить связь.
Разность значений равна 0,5 или меньше — сила притяжения у атомов практически равна, электронное облако находится примерно посередине расстояния между атомами веществ, а связь является ковалентной неполярной. Если молекула состоит из двух одинаковых атомов, то разность значений электроотрицательностей равна 0. Атомы в молекуле с ковалентной полярной связью прочно соединены.
Разность значений составляет от 0,5 до 1,6 — сила притяжения у одного из атомов значительно больше, и он смещает общую электронную пару к себе, приобретая таким образом частичный отрицательный заряд. Атом, от которого общая электронная пара на более далеком расстоянии, приобретает частичный положительный заряд. Между атомами возникает ковалентная полярная связь. Сдвиг общей электронной пары приводит к определенному дисбалансу и молекула может вступать в определенные химические превращения.
Разность значений равна 2,0 и выше. В этом случае общая пара электронов достанется атому, чья электроотрицательность больше. Заряд у такого атома становится отрицательным, а у другого атома в молекуле за счет потери электрона — положительным. Между атомами возникает ионная связь. Ионная связь нестойкая, и молекулы легко вступают в реакции с другими атомами и полярными молекулами.
Разность значений составляет от 1,6 до 2,0. Самый сложный для определения тип связи, поскольку зависит от входящих в состав молекулы атомов. Если в молекулу входит атом металла, то связь ионная. Если в молекуле атомы металла отсутствуют — связь ковалентная полярная.
Источник
Электроотрицательность элементов по таблице Менделеева
Электроотрицательность — это характеристика атома, показывающая, насколько высока его способность притягивать к себе электроны. Когда химическая связь образована двумя разными элементами, электроны у одного из них всегда расположены более плотно, чем у другого. Тот атом, у которого электронная плотность выше, называется электроотрицательным, тот, у кого ниже — соответственно, электроположительным.
Как определить электроотрицательность
Существует несколько шкал, ориентируясь на которые, можно определить электроотрицательность того или иного элемента. Попробуем их перечислить:
- Таблица Менделеева.
- Шкала Малликена.
- Шкала Полинга.
- Шкала Олреда-Рохова.
Чтобы определить параметр «электроотрицательность» по таблице Менделеева, нужно всего лишь знать, что наиболее электроотрицательные свойства имеют те элементы, которые располагаются вверху таблицы и в правой ее части. То есть, чем выше и правее элемент находится в таблице Менделеева, тем выше у него электроотрицательность и наоборот, чем ниже и левее — тем выше у него электроположительность.
Шкала Полинга — наиболее часто используемая таблица электроотрицательности. Названа она в честь американского химика Лайнуса Полинга, который впервые ввел понятие электроотрицательности. Согласно шкале Поллинга, электроотрицательность всех имеющихся в природе элементов лежит в интервале от 0,7 (таковой она является у щелочного металла франция) до 4,0 (у газа-галогена фтора). В таблице приводятся относительные и неточные величины.
Шкала Малликена рассматривает электроотрицательность как величину энергии связи между валентными электронами. Приводятся максимально точные расчеты.
Расположение элементов в каждой из таблиц является идентичным, несмотря на то, что методы определения отличаются друг от друга, и величины тоже.
Самые высокие значения электроотрицательности
Фтор, один из галогенов — это элемент, обладающий наивысшей электроотрицательностью, а точнее — 3,98. Его химическая активность невероятно высока, настолько, что химики называют его не иначе как «все разгрызающий».
Следом за фтором идет кислород. Электроотрицательность кислорода немного пониже — 3,44, но тоже достаточно высока.
Следом за ними (спускаясь все ниже по правой части таблицы Менделеева) идут:
Большая часть неметаллов имеет электроотрицательность, колеблющуюся между значениями 2 и 3. У отличающихся наиболее высокой активностью металлов, от франция до бериллия, она колеблется от значения 0,7 до 1,57.
Как определить валентные электроны
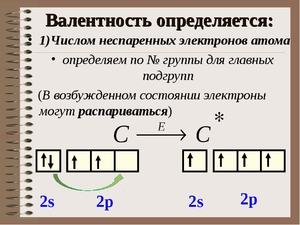
Валентностью называют способность атома вступать во взаимодействие с другими атомами, образуя с ними определенные химические связи. Валентными электронами именуются электроны, непосредственно участвующие в образовании химической связи. Основными создателями, внесшими в теорию валентности наибольший вклад, являются русский ученый Бутлеров и немецкий ученый Кекуле. Электроны, которые принимают участие в образовании химической связи, называют валентными.
Атом, как мы все знаем из школьного курса, устроен таким образом, что довольно-таки напоминает по своему устройству Солнечную систему. В центре атома находится огромное ядро, чья масса чуть менее, чем полностью равняется массе всего атома, а вокруг него по орбиталям вращаются мелкие электроны, неодинаковые по своим внутренним характеристикам. Ядро атома окажется не таким уж и большим, если сравнить его размеры с длиной расстояния до орбиталей, по которым вращаются атомы. Чем дальше от ядра и чем ближе к внешней электронной оболочке находится электрон конкретно взятого атома, тем быстрее он вступает во взаимодействие с электронами других атомов.
Итак, перед нами таблица Менделеева. Найти на ней нужно третий период. Последовательно перебираем элементы главных подгрупп в нем. Существует правило, согласно которому валентность элемента определяется по номеру его группы и равняется количеству электронов на внешней оболочке его атома.
- У щелочного металла натрия на внешней оболочке всего только один электрон, принимающий участие в химической связи между элементами. Исходя из этого, мы определяем, что он одновалентен.
- У щелочноземельного металла на внешней оболочке уже два электрона. Это означает, что его валентность равна двум.
- У амфотерного металла алюминия ровно три электрона на внешней оболочке. Его валентность так же, как и у предыдущих элементов, соответствует этому числу.
- У кремния четыре электрона, он четырехвалентен.
- Фосфор может образовывать различные связи и иметь разные валентности, но высшая валентность фосфора равна пяти.
- Сера точно так же, как и фосфор, может иметь разные валентности, но высшая равняется шести.
- Возьмем хлор. Когда, к примеру, он состоит в молекуле соляной кислоты (HCl), он находится в одновалентном состоянии. А вот в молекуле хлорной кислоты (HClO4) он сразу же становится семивалентным.
Помимо главных, есть еще и побочные подгруппы. Когда дело касается их, учитываются еще и d-электроны на предыдущем подуровне. В таблице Менделеева все эти значения легко можно отыскать. Попробуем определить высшую валентность хрома. На внешнем уровне у хрома находится 1 электрон, на d-подуровне — 5. Следовательно, его высшая валентность равна 6. У марганца на внешнем уровне 2 электрона, на d-подуровне — 5. Значит, его высшая валентность — 7.
Все вышеописанное, за некоторыми исключениями, действительно для элементов всех других побочных подгрупп (помимо тех, в которые включены марганец и хром). Вот исключения:
Видео
Это видео поможет вам лучше усвоить такое понятие, как электроотрицательность.
Источник
Что такое электроотрицательность
Одно из основополагающих понятий в химии – электроотрицательность .
Электроотрицательность — это свойство атома притягивать к себе общие электронные пары, образующиеся химическую связь.
Можно говорить также, что электроотрицательность – способность атома притягивать к себе электроны других атомов при образовании химической связи. Существуют количественные характеристики электроотрицательности, но в курсе неорганической химии 8 класса они не изучаются. Нам будет достаточно качественного определения этого понятия.
В первую очередь надо запомнить следующее:
электроотрицательность растёт при движении по периоду таблицы Менделеева слева направо и падает при движении по группе сверху вниз.
Инертные газы (элементы VIII группы) имеют завершённый внешний электронный слой, поэтому понятие электроотрицательности к ним неприменимо, их мы в расчёт брать не будем. А теперь давайте сразу рассмотрим примеры, чтобы наглядно это увидеть. Взгляните на второй период таблицы Менделеева , он выглядит так:
Так вот при движении от лития к фтору электроотрицательность растёт, то есть минимальная электроотрицательноть будет во втором периоде у лития, максимальная – у фтора. Аналогичная ситуация наблюдается во всех периода: в начале стоят элементы с низкой электроотрицательностью, в конце – с высокой.
Теперь взглянем на первую группу :
При движении сверху вниз электроотрицательность падает, то есть теперь у лития будет максимальная электроотрицательность, а у франция – минимальная. Точно так же происходит и в других группах: чем выше элемент, тем выше электроотрицательность.
элементы с максимальной электроотрицательностью сосредоточены в правом верхнем углу таблицы, с минимальной – в левом нижнем.
Также можно говорить, что неметаллы имеют высокую электроотрицательность, а металлы – низкую.
Зачем нужна электроотрицательность
Этот вопрос логичен, ведь мы уже столько поговорили об этом понятии, но так и не применили его на практике. Согласно определению,
электроотрицательность – это способность атома притягивать электронную пару.
Атомы с высокой электроотрицательностью будут сильно притягивать электронные пары, атомы с низкой электроотрицательностью будут пары отдавать. Чтобы это понять, рассмотрим ещё несколько примеров.
В хлориде натрия NaCl атом хлора будет притягивать электронную пару, а атом натрия отдавать (посмотрите в таблицу Менделеева и убедитесь, что хлор стоит сильно правее натрия). Кроме того, выше говорилось, что атомы металлов отдают электроны, а атомы неметаллов – притягивают их, именно это мы здесь и наблюдаем: натрий – металл, он имеет низкую электроотрицательность и отдаёт электроны, а атом хлор – неметалл, он имеет высокую электроотрицательность и притягивает электроны.
Ещё один пример – оксид азота (II) NO. Здесь два неметалла, но у кислорода электроотрицательность значительно выше (обратитесь к таблице и посмотрите на положение этих элементов). То есть в этом соединении отдавать электроны будет азот, а притягивать их будет кислород.
Понятие электроотрицательности нельзя игнорировать, с ним непременно нужно разобраться, поскольку оно необходимо для понимания образования химической связи.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник