Атомы и электроны
Атомно-молекулярное учение
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома — порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s 2 )
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.
Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются еще одним электроном с противоположным направлением
- Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод — 1s 2 2s 2 2p 2
- Серы — 1s 2 2s 2 2p 6 3s 2 3p 4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне — это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод — 2s 2 2p 2 (4 валентных электрона)
- Сера -3s 2 3p 4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.
- Углерод — 2s 2 2p 2 (2 неспаренных валентных электрона)
- Сера -3s 2 3p 4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Запишем получившиеся электронные конфигурации магния и фтора:
- Магний — 1s 2 2s 2 2p 6 3s 2
- Скандий — 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1
Источник
Основное и возбужденное состояние атома
Почему одни атомы могут иметь только одну валентность, а другие — несколько? Для ответа на этот вопрос обратимся к квантово-механической модели строения атома, согласно которой, электроны вокруг атомного ядра располагаются на, так называемых, энергетических уровнях (см. Электронная структура атомов).
Как известно, атомы могут вступать в химические реакции с другими атомами, с образованием химических связей, путем отдачи/принятия своих/чужих электронов, которые называются валентными (см. Валентность).
В Периодической таблице химических элементов Д. И. Менделеева все атомы отображены в их основном состоянии (состоянии с минимальной энергией). Основное состояние атома описывается электронной конфигурацией атома, согласно его положению в Периодической таблице (см. Таблицу электронных конфигураций атомов химических элементов по периодам.
В определенных ситуациях, некоторые атомы, получая энергию извне, переходят в, так называемое, возбужденное состояние, в котором пребывают относительно короткое время, поскольку возбужденное состояние является нестабильным, после чего возбужденный атом отдает энергию и возвращается в свое основное (стабильное) состояние.
Рассмотрим основное и возбужденное состояние атома на конкретных примерах.
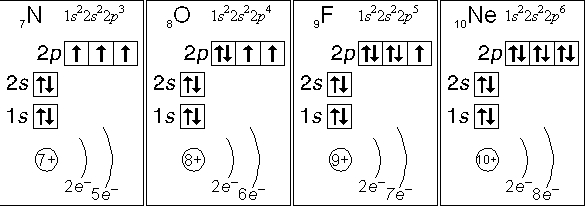
Рис. Электронные конфигурации атомов азота, кислорода, фтора, неона.
- атом азота (N):
- кол-во неспаренных электронов: 3
- ковалентность: 3
- атом кислорода (О):
- кол-во неспаренных электронов: 2
- ковалентность: 2
- атом фтора (F):
- кол-во неспаренных электронов: 1
- ковалентность: 1
- атом неона (Ne):
- кол-во неспаренных электронов: 0
- ковалентность: 0
Азот, кислород, фтор и неон не могут иметь возбужденного состояния по той простой причине, что они не имеют свободной орбитали с более высокой энергией, на которую могли бы «перескакивать» спаренные электроны с орбиталей с меньшей энергией.
Рассмотрим атом серы, который находится в одной с кислородом группе — 16 (VIa), но, в отличие от кислорода, у атома серы имеется свободная d-орбиталь, существенно расширяющая валентные возможности элемента:
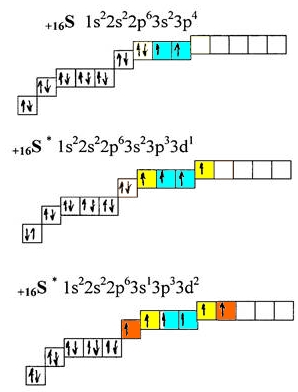
Рис. Возбужденное состояние атома серы.
В основном состоянии атом серы имеет 2 валентных электрона (голубой цвет). Как видно из вышеприведенного рисунка, получая энергию извне, у атома серы могут появляться еще 2 (желтый цвет) или 4 (желтый+оранжевый) дополнительных валентных электрона, при этом общее кол-во валентных электронов увеличивается до 4 или 6 соответственно.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник
Возбужденные атомы: 1. Кто такие и где встречаются

Три изображения атома: стилизованное, упрощенное и более реалистичное. Упрощенная модель нарисована в соответствии с устаревшей боровской моделью атома, но она удобна для иллюстраций перехода электрона с орбиты на орбиту. Однако не поддавайтесь ложному впечатлению, которое она создает! Реальные электроны в атоме — это вовсе не маленькие шарики, которые летают по четко заданным орбитам; они больше напоминают размазанные в пространстве облака электронной плотности
Атомы — элементарные кирпичики вещества — устроены, на первый взгляд, очень просто. Внутри атома тяжелое и очень компактное ядро, вокруг которого движутся несколько электронов. Законы квантовой механики говорят, что электроны не могут двигаться как угодно, а должны образовывать определенную устойчивую конфигурацию, которая имеет наименьшую энергию и сама по себе уже не развалится. Эта конфигурация называется основным состоянием атома; практически все атомы вокруг нас — именно такие. Вся химия, всё многообразие веществ и материалов возникает из того, как взаимодействуют друг с другом атомы в основном состоянии.
Однако электронную конфигурацию можно «взбаламутить», посветив на атом светом или как-то иначе передав ему дополнительную энергию. Форма электронной оболочки изменится, полная энергия атома повысится, и атом перейдет в новое состояние, которое называется возбужденным. Опять же, по законам квантовой механики возбужденные состояния не могут быть какие угодно, они должны быть строго определенными, с некоторой дополнительной энергией, зависящей от типа возбуждения. Поэтому возбужденные состояния занимают определенные энергетические уровни, причем эта лесенка уровней энергии — своя для каждого сорта атомов.
Вверху: электронные облака для некоторых возбужденных состояний атома водорода. Внизу: энергетический спектр атома водорода. Изображение с сайта en.wikipedia.org
Передав атому очень много лишней энергии, его можно возбудить настолько сильно, что электрон попросту от него оторвется и улетит прочь. Такой процесс называется ионизацией, а получившийся положительно заряженный «недоатом» — ионом. Оставшиеся у иона электроны можно возбуждать дальше, но только лесенка, — или, на научном языке, спектр — возбужденных уровней энергии у него уже будет отличаться от исходного атома. Экстремальный случай возбуждения — это когда у атома отбирают вообще все электроны, и от него остается лишь голое ядро. Так бывает либо при очень высокой температуре, либо в экстремальных условиях, например, при поглощении сверхмощной световой вспышки.
То, что у каждого сорта атомов и даже у каждого типа ионов одного элемента есть свой собственный спектр возбужденных состояний, — очень помогает физикам. Это дает им исключительно удобный метод диагностики на расстоянии, без непосредственного контакта, и самого вещества, и физических условий, в которых оно находится.
Спектральный состав света, исходящего от полярного сияния, позволяет определить, какие именно молекулы испускают это сияние и с какой интенсивностью. Изображение с сайта atoptics.co.uk
Например, в глубоком космосе встречаются огромные облака частично ионизированного газа. От него идет свет, в спектре которого встречаются многочисленные линии излучения или поглощения. Расшифровав эти спектры, можно найти в них «личную подпись» каждого типа ионов, находящихся в том далеком облаке. Сравнив интенсивность линий друг с другом, можно узнать, каких ионов там больше, а отсюда оценить температуру и плотность газа. Ну а если вдруг в спектре светящихся космических облаков встретится какая-то «анонимка» — линия излучения, не соответствующая ни одному известному иону, — это производит в физике настоящий фурор. Один пример такой ситуации, которая развивается прямо на наших глазах, см. в новостях В спектрах скоплений галактик обнаружена неизвестная линия излучения и Новые результаты не подтверждают загадочную рентгеновскую линию излучения
Источник
Возбужденные атомы: 1. Кто такие и где встречаются

Три изображения атома: стилизованное, упрощенное и более реалистичное. Упрощенная модель нарисована в соответствии с устаревшей боровской моделью атома, но она удобна для иллюстраций перехода электрона с орбиты на орбиту. Однако не поддавайтесь ложному впечатлению, которое она создает! Реальные электроны в атоме — это вовсе не маленькие шарики, которые летают по четко заданным орбитам; они больше напоминают размазанные в пространстве облака электронной плотности
Атомы — элементарные кирпичики вещества — устроены, на первый взгляд, очень просто. Внутри атома тяжелое и очень компактное ядро, вокруг которого движутся несколько электронов. Законы квантовой механики говорят, что электроны не могут двигаться как угодно, а должны образовывать определенную устойчивую конфигурацию, которая имеет наименьшую энергию и сама по себе уже не развалится. Эта конфигурация называется основным состоянием атома; практически все атомы вокруг нас — именно такие. Вся химия, всё многообразие веществ и материалов возникает из того, как взаимодействуют друг с другом атомы в основном состоянии.
Однако электронную конфигурацию можно «взбаламутить», посветив на атом светом или как-то иначе передав ему дополнительную энергию. Форма электронной оболочки изменится, полная энергия атома повысится, и атом перейдет в новое состояние, которое называется возбужденным. Опять же, по законам квантовой механики возбужденные состояния не могут быть какие угодно, они должны быть строго определенными, с некоторой дополнительной энергией, зависящей от типа возбуждения. Поэтому возбужденные состояния занимают определенные энергетические уровни, причем эта лесенка уровней энергии — своя для каждого сорта атомов.
Вверху: электронные облака для некоторых возбужденных состояний атома водорода. Внизу: энергетический спектр атома водорода. Изображение с сайта en.wikipedia.org
Передав атому очень много лишней энергии, его можно возбудить настолько сильно, что электрон попросту от него оторвется и улетит прочь. Такой процесс называется ионизацией, а получившийся положительно заряженный «недоатом» — ионом. Оставшиеся у иона электроны можно возбуждать дальше, но только лесенка, — или, на научном языке, спектр — возбужденных уровней энергии у него уже будет отличаться от исходного атома. Экстремальный случай возбуждения — это когда у атома отбирают вообще все электроны, и от него остается лишь голое ядро. Так бывает либо при очень высокой температуре, либо в экстремальных условиях, например, при поглощении сверхмощной световой вспышки.
То, что у каждого сорта атомов и даже у каждого типа ионов одного элемента есть свой собственный спектр возбужденных состояний, — очень помогает физикам. Это дает им исключительно удобный метод диагностики на расстоянии, без непосредственного контакта, и самого вещества, и физических условий, в которых оно находится.
Спектральный состав света, исходящего от полярного сияния, позволяет определить, какие именно молекулы испускают это сияние и с какой интенсивностью. Изображение с сайта atoptics.co.uk
Например, в глубоком космосе встречаются огромные облака частично ионизированного газа. От него идет свет, в спектре которого встречаются многочисленные линии излучения или поглощения. Расшифровав эти спектры, можно найти в них «личную подпись» каждого типа ионов, находящихся в том далеком облаке. Сравнив интенсивность линий друг с другом, можно узнать, каких ионов там больше, а отсюда оценить температуру и плотность газа. Ну а если вдруг в спектре светящихся космических облаков встретится какая-то «анонимка» — линия излучения, не соответствующая ни одному известному иону, — это производит в физике настоящий фурор. Один пример такой ситуации, которая развивается прямо на наших глазах, см. в новостях В спектрах скоплений галактик обнаружена неизвестная линия излучения и Новые результаты не подтверждают загадочную рентгеновскую линию излучения
Источник












