- Кристаллические и аморфные тела
- Чем отличаются кристаллические и аморфные тела
- Плавление аморфных тел
- Примеры аморфных тел
- Плавление кристаллических тел
- Примеры кристаллических тел
- Как на графике выглядит процесс плавления кристаллического тела
- Как на графике выглядит процесс кристаллизации для кристаллического тела
- Кристаллические и аморфные тела
- Структура кристаллических тел
- Основные виды кристаллических решеток
- Кристаллические и аморфные тела
- Твердые тела
- Аморфные тела
- Кристаллические тела
- Что мы узнали?
Кристаллические и аморфные тела
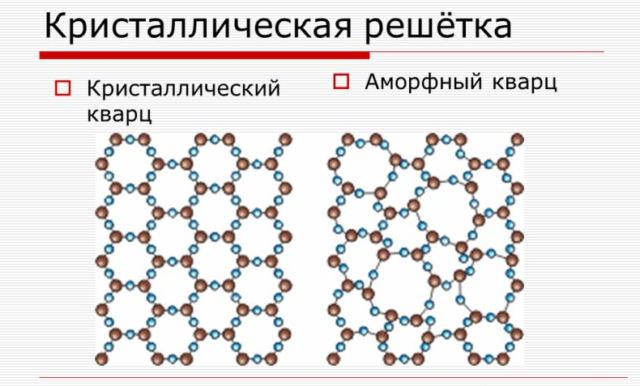
Рассмотрим твердые тела подробнее. По упорядоченности мельчайших частиц, из которых состоят твердые тела, их можно разделить на аморфные и кристаллические.
Чем отличаются кристаллические и аморфные тела
У кристаллических тел есть строго упорядоченное положение мельчайших частиц. Эти частички образуют правильную кристаллическую решетку (рис. 1).
Примечание: Атомы кристаллических тел располагаются в узлах кристаллической решетки. Связи между атомами обозначены линиями. Эти линии у различных кристаллических тел образуют разные пространственные фигуры.
Аморфные тела не обладают строгой упорядоченностью мельчайших частиц — молекул, из которых они состоят. У аморфных тел порядок есть, но он не так выражен, как у кристаллических тел. Аморфное тело по своему строению больше похоже на очень вязкую жидкость, чем на твердое тело. Поэтому, аморфные тела обладают текучестью.
Основные отличия кристаллических и аморфных тел приведены на рисунке 2.
Примечания:
- Благодаря текучести, спустя много лет после изготовления, верхняя часть установленного в раму оконного стекла, становится немного тоньше, чем его нижняя часть.
- Канифоль со временем может принимать форму сосуда, в который ее поместили.
Переход:
- из жидкого в твердое состояние – кристаллизация;
- из твердого в жидкое состояние – плавление;
Плавление аморфных тел
Аморфные тела конкретной температуры плавления не имеют. Строение аморфных тел больше похоже на очень вязкую жидкость, чем на твердое кристаллическое тело. Во время нагревания они будут становиться более текучими, все больше проявляя свойство жидкости. При этом, хрупкость, присущая твердому состоянию, будет исчезать. Одновременно с плавлением, температура аморфных тел будет повышаться.
Важно! Одновременно с плавлением, температура аморфных тел будет непрерывно повышаться. Потому, что такие тела не имеют конкретной температуры плавления.
Примеры аморфных тел
- канифоль (смола хвойных деревьев);
- стекло;
- эбонит;
- сургуч;
- различные пластмассы;
Примечание: Эбонит («Эбенос» др.-греч. — чёрное дерево) – это вулканизированный каучук с добавлением большого количество серы, до 50 % от массы каучука. Цвет эбонита обычно тёмно-бурый или чёрный. Этот материал не проводит электрических ток – то есть, является хорошим изолятором.
Плавление кристаллических тел
Чтобы кристаллическое тело начало плавиться, его нужно нагреть до определенной температуры. Одни кристаллические тела будут плавиться при низкой температуре, а другие – при высокой. То есть, у каждого вещества своя температура плавления. Ее можно найти в справочнике физики. При этом, пока вещество не расплавится, его температура изменяться не будет.
Важно! Кристаллические тела имеют конкретную температуру плавления. Пока кристаллическое вещество полностью не расплавится, его температура не изменится!
Примечания:
- Кристаллические вещества плавятся при той же температуре, при которой они будут превращаться в твердое тело (кристаллизоваться).
- Чтобы жидкое вещество начало кристаллизоваться, оно сначала должно остыть до определенной температуры.
- Температура плавления и температура кристаллизации – это одна и та же температура.
Примеры кристаллических тел
- лед;
- свинец;
- алюминий;
- ртуть;
- железо;
- золото;
- серебро;
Как на графике выглядит процесс плавления кристаллического тела
Рассмотрим переход из твердого состояния в жидкое — плавление и, обратно — кристаллизацию, на примере льда.
Возьмем лед при начальной температуре «-40» градусов по Цельсию (рис. 3) и поместим его в кастрюльку. Поставим эту кастрюльку на газовую плиту и начнем нагревать лед.
Процесс нагревания льда изображается наклонной линией синего цвета. Потому, что время идет, а температура льда повышается.
Во время нагревания льда от отрицательной температуры до нуля градусов, в емкости будет содержаться только твердый лед.
Как только будет достигнута температура плавления льда – «0» градусов по Цельсию, лед начнет превращаться в жидкость. В кастрюльке начнет понемногу появляться вода. То есть, будет присутствовать и лед, и вода одновременно. Постепенно воды становится все больше, а льда – все меньше.
Мы продолжаем подавать тепловую энергию. Но температура льда во время плавления не меняется до тех пор, пока весь лед не расплавится и не превратится в жидкость.
Поэтому на графике температуры плавление кристаллических тел изображается горизонтальной линией. На рисунке 3 эта линия выделена красным цветом.
Примечания:
- Чтобы тело расплавить, ему нужно передать тепловую энергию. Значит, при плавлении, тепловая энергия поглощается телом.
- При плавлении кристаллических тел, вся полученная тепловая энергия тратится на разрушение кристаллической решетки. Поэтому кристаллические тела имеют конкретную температуру плавления. Она не будет повышаться до тех пор, пока все кристаллическое тело полностью не расплавится.
Когда лед полностью расплавится, в кастрюльке будет присутствовать только жидкая вода. На рисунке 5 это — крайняя правая точка на горизонтальной красной линии.
Если продолжать подводить тепловую энергию, температура воды начнет повышаться. Идет процесс нагревания воды. На графике процесс нагревания – это еще одна наклонная прямая линия, она располагается справа от красной линии плавления.
Как на графике выглядит процесс кристаллизации для кристаллического тела
Давайте теперь прекратим нагревание воды, вынесем кастрюльку на мороз и, оставим ее там на какое-то время. Вода начнет охлаждаться, ее температура будет понижаться. На рисунке 4 это отражено убывающей до нуля прямой наклонной синей линией.
Когда вода охладится до нуля градусов, начнется процесс превращения жидкости в твердое тело – лед. Потому, что ноль градусов Цельсия – это температура не только плавления, но и кристаллизации льда. Вначале начнут появляться маленькие льдинки. Этому соответствует левая часть красной горизонтальной линии на графике 4.
Примечание: Если в воде присутствуют пылинки, или другие мелкие примеси, то кристаллизация проходит быстрее. Такие мелкие примеси называют центрами кристаллизации.
Постепенно, количество льда увеличивается, а воды становится все меньше. При этом, температура воды и льда в кастрюльке продолжает оставаться равной нулю градусов по Цельсию.
Когда вся вода в кастрюльке превращается в лед – этому соответствует крайняя правая точка на красной линии на графике.
Только после этого температура льда начинает понижаться от нуля в отрицательную область температур. На рисунке это описано наклонной синей линией, примыкающей справа к горизонтальной красной линии.
Примечание: Чтобы тело перешло из жидкого состояния в твердое (кристаллизовалось), оно должно избавиться от избытка тепловой энергии. Значит, при кристаллизации, тело отдает энергию окружающим телам. Физики скажут так: «Тело выделяет тепловую энергию во внешнюю среду».
Источник
Кристаллические и аморфные тела
В зависимости от физических свойств и молекулярной структуры выделяют два основных класса твердых тел – кристаллические и аморфные.
Аморфные тела обладают такой чертой, как изотропность. Это понятие означает, что они относительно независимы от оптических, механических и других физических свойств и направления, в котором на них воздействуют внешние силы.
Основная черта афморных тел – хаотичное расположение атомов и молекул, которые собираются лишь в небольшие локальные группы, не более чем по несколько частиц в каждой.
Это свойство сближает аморфные тела с жидкостями. К таким твердым телам относятся янтарь и другие твердые смолы, различные виды пластика и стекло. Под воздействием высоких температур аморфные тела размягчаются, однако для их перевода в жидкость необходимы сильные воздействия тепла.
Структура кристаллических тел
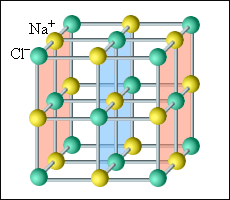
Все кристаллические тела имеют четкую внутреннюю структуру. Группы частиц в одном и том же порядке периодически повторяются во всем объеме такого тела. Чтобы наглядно представить такую структуру, обычно используют пространственные кристаллические решетки. Они состоят из определенного количества узлов, которые образуют центры молекул или атомов конкретного вещества. Обычно такая решетка построена из ионов, входящих в состав нужных молекул. Так, в поваренной соли внутренняя структура состоит из ионов натрия и хлора, попарно объединенных в молекулы. Подобные кристаллические тела называются ионными.
Рисунок 3 . 6 . 1 . Кристаллическая решетка поваренной соли.
В структуре каждого вещества можно выделить одну минимальную составляющую – элементарную ячейку.
Вся решетка, из которой состоит кристаллическое тело, может быть составлена путем трансляции (параллельного переноса) такой ячейки в определенных направлениях.
Основные виды кристаллических решеток
Число видов кристаллических решеток не бесконечно. Всего насчитывается 230 видов, большинство которых создано искусственным путем или найдено в природных материалах. Структурные решетки могут принимать формы объемно центрированных кубов (например, у железа), гранецентрированных кубов (у золота, меди), призмы с шестью гранями (магний, цинк).
В свою очередь кристаллические тела подразделяются на поликристаллы и монокристаллы. Большинство веществ относятся к поликристаллам, т.к. они состоят из так называемых кристаллитов. Это маленькие кристаллики, сросшиеся между собой и ориентированные хаотически. Монокристаллические вещества встречаются сравнительно редко, даже среди искусственных материалов.
Поликристаллы обладают свойством изотропности, то есть одинаковыми свойствами во всех направлениях.
Поликристаллическая структура тела хорошо видна под микроскопом, а у некоторых материалов, например, чугуна, и невооруженным взглядом.
Полиморфизм – это возможность вещества существовать в нескольких фазах, т.е. кристаллических модификациях, которые отличаются друг от друга физическими свойствами.
Процесс перехода в другую модификацию получил название полифморного перехода.
Примером такого явления может быть превращение графита в алмаз, который в промышленных условиях происходит при высоком давлении (до 100 000 атмосфер) и высоких температурах
(до 2000 К ).
Чтобы изучить структуру кристаллической решетки монокристалла или поликристаллического образца, используется дифракция рентгеновского излучения.
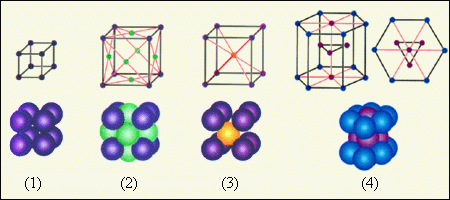
Простые кристаллические решетки показаны на рисунке ниже. Необходимо учитывать, что расстояние между частицами так мало, что сопоставимо с размерами самих этих частиц. Для наглядности на схемах показаны только положения центров.
Рисунок 3 . 6 . 2 . Простые кристаллические решетки: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемноцентрированная кубическая решетка; 4 – гексагональная решетка.
Наиболее простой является кубическая решетка: такая структура состоит из кубов с частицами в вершинах. Гранецентрированная решетка имеет частицы не только в вершинах, но и на гранях. Например, кристаллическая решетка поваренной соли представляет собой две гранецентрированные решетки, вложенные друг в друга. Объемноцентрированная решетка имеет дополнительные частицы в центре каждого куба.
У решеток металлов есть одна важная черта. Ионы вещества удерживаются на своих местах благодаря взаимодействию с газом свободных электронов. Так называемый электронный газ образуется за счет одного или нескольких электронов, отдаваемых атомами. Такие свободные электроны могут перемещаться по всему объему кристалла.
Рисунок 3 . 6 . 3 . Структура металлического кристалла.
Источник
Кристаллические и аморфные тела

Средняя оценка: 4
Всего получено оценок: 157.
Средняя оценка: 4
Всего получено оценок: 157.
В зависимости от внутреннего строения твердые тела бывают либо кристаллическими, либо аморфными. Молекулы и атомы кристаллов расположены в определенной, повторяющейся последовательности на больших расстояниях, сохраняя так называемый дальний порядок. Атомы и молекулы в аморфных телах размещены неупорядоченно, для них характерен ближний порядок со строением аналогичным жидкому состоянию вещества. Рассмотрим основные отличия кристаллических тел от аморфных, которые проявляются в их физических свойствах.
Твердые тела
Все твердые тела обладают следующими общими свойствами:
- Способностью долгое время сохранять форму и объем (геометрические размеры);
- Наличием упругих сил, которые возникают при небольших изменениях объема от внешнего воздействия (сжатия, растяжения или сдвига).
Современные ученые исследуют пространственное расположение атомов и молекул в твердых телах с помощью электронных микроскопов, которые позволяют получить изображение объекта с сильным увеличением (до 10 6 раз). Первый электронный микроскоп был изобретен в 30-х годах прошлого века. В 2018 г. с помощью последних версий этого прибора было получено разрешение 0,39 ангстрем. Напомним, что 1 ангстрем равен 10 -8 см. В большинстве кристаллов это соответствует шагу атомной решетки.
Аморфные тела
Смола, воск, графит, изделия из стекла и янтаря, пластмассы — все это примеры аморфных тел (от греч.слова Amorphous — бесформенный, некристаллический).
Характерной особенностью аморфных тел является отсутствие определенной температуры плавления, то есть отсутствует четкий переход от твердого состояния к жидкому: при нагревании аморфное тело становится только более текучим.
Кристаллические тела
Твердые тела, в которых молекулы и атомы расположены упорядоченно и образуют периодически повторяющуюся структуру, называются кристаллами. Физические свойства кристаллов (упругие, механические, тепловые, электрические, магнитные, оптические) в разных направлениях неодинаковы. Такое свойство называется анизотропностью. Анизотропия кристаллов объясняется тем, что при упорядоченном расположении частиц расстояния между ними и силы взаимодействия (притяжения и отталкивания) оказываются неодинаковыми в разных направлениях.
Различают кристаллические тела двух видов: монокристаллы и поликристаллы. Главным признаком монокристаллов является повторяющееся внутреннее строение (структура) во всем объеме тела.
Поликристалл — это совокупность (набор) сросшихся друг с другом, хаотически ориентированных, небольших кристаллов. Каждый маленький кристалл обладает свойствами анизотропии, но их совокупность — поликристалл — изотропен.

Часто встречаются кристаллические тела одинаковые по своему химическому составу, но обладающие очень разные физические свойства. Самый известный пример — это углерод, имеющий две модификации: графит и алмаз. Разное строение кристаллических решеток является причиной того, что алмаз имеет рекордные показатели твердости, а графит из-за его мягкости используется в качестве грифелей для карандашей.
Что мы узнали?
Итак, мы узнали, что кристаллические и аморфные тела кроме общих признаков, которые относят их к твердым телам, имеют совершенно разные физические свойства. Аморфные тела обладают изотропными свойствами, а для кристаллов характерна анизотропия физических параметров. Кристаллические тела делятся на монокристаллы и поликристаллы.
Источник