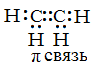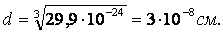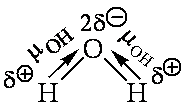- Кратные связи
- Смотреть что такое «Кратные связи» в других словарях:
- КРАТНЫЕ СВЯЗИ
- Полезное
- Смотреть что такое «КРАТНЫЕ СВЯЗИ» в других словарях:
- Простые и кратные связи
- Что значит активные кратные связи
- 4.1. Насыщаемость ковалентной связи
- 4.2. Энергия связи
- 4.3. Длина связи
- 4.4. Кратность связи
- 4.5. Полярность связи
- Если двухатомная молекула состоит из атомов одного элемента, как, например, молекулы Н2, N2, Cl 2 и т. п., то каждое электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распределяется в пространстве симметрично относительно ядер обоих атомов. В подобном случае ковалентная связь называется неполярной или гомеополярной. Если же двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает асимметрия в распределении заряда. В таких случаях ковалентная связь называется полярной или гетерополярной.
- 4.6. Типы ковалентных молекул
- 4.7. Вопросы и задания
Кратные связи
Большая советская энциклопедия. — М.: Советская энциклопедия . 1969—1978 .
Смотреть что такое «Кратные связи» в других словарях:
КРАТНЫЕ СВЯЗИ — хим. связи двухцентрового типа, к рые в отличие от простой связи образованы более чем одной парой электронов. По числу пар электронов, образующих К. с., различают двойные, тройные и четверные связи. В приближении молекулярных орбиталей методов К … Химическая энциклопедия
КРАТНЫЕ СВЯЗИ — двухцентровые хим. связи, к рые в отличие от простой связи образованы более чем одной электронной парой. По числу пар электронов, образующих К. с. различают двойные связи, реализующиеся, напр., в алке нах R2C=CR2 и кетонах R2C=O, и тройные, напр … Естествознание. Энциклопедический словарь
КРАТНЫЕ СВЯЗИ — хим. связи, в образовании к рых участвует более чем одна пара электронов (см. Двойная связь, Тройная связь). В молекуле соединения, содержащей 2 или большее число К. с., эти связи могут примыкать к одному и тому же атому, как, напр., в аллене H2C … Большой энциклопедический политехнический словарь
Кратные единицы — Приставки СИ (десятичные приставки) приставки перед названиями или обозначениями единиц измерения физических величин, применяемые для формирования кратных и дольных единиц, отличающихся от базовой в определённое целое, являющееся степенью числа… … Википедия
Кратные приставки для образования производных единиц — Приставки СИ (десятичные приставки) приставки перед названиями или обозначениями единиц измерения физических величин, применяемые для формирования кратных и дольных единиц, отличающихся от базовой в определённое целое, являющееся степенью числа… … Википедия
Теория изогнутой химической связи — предложена Лайнусом Полингом на симпозиуме по теоретической органической химии, посвящённом памяти А.Кекуле (симпозиум состоялся в Лондоне в сентябре 1958 г.). В докладе Полинга дана теория двойной связи как комбинации двух одинаковых изогнутых… … Википедия
Сигма- и пи-связи — (σ и π связи) ковалентные химические связи, характеризующиеся определенней, но различной пространственной симметрией распределения электронной плотности. Как известно, ковалентная связь образуется в результате обобществления электронов… … Большая советская энциклопедия
СОПРЯЖЁННЫЕ СВЯЗИ — см. в ст. Кратные связи … Большой энциклопедический политехнический словарь
ТРОЙНЫЕ СВЯЗИ — см. Кратные связи … Естествознание. Энциклопедический словарь
Конъюгированные связи — сопряжённые связи, химические кратные (двойные или тройные) связи, разделённые одной простой связью, например . Подробнее см. Сопряжение связей … Большая советская энциклопедия
Источник
КРАТНЫЕ СВЯЗИ
Химическая энциклопедия. — М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Полезное
Смотреть что такое «КРАТНЫЕ СВЯЗИ» в других словарях:
КРАТНЫЕ СВЯЗИ — двухцентровые хим. связи, к рые в отличие от простой связи образованы более чем одной электронной парой. По числу пар электронов, образующих К. с. различают двойные связи, реализующиеся, напр., в алке нах R2C=CR2 и кетонах R2C=O, и тройные, напр … Естествознание. Энциклопедический словарь
КРАТНЫЕ СВЯЗИ — хим. связи, в образовании к рых участвует более чем одна пара электронов (см. Двойная связь, Тройная связь). В молекуле соединения, содержащей 2 или большее число К. с., эти связи могут примыкать к одному и тому же атому, как, напр., в аллене H2C … Большой энциклопедический политехнический словарь
Кратные связи — тип химической связи, осуществляемой двумя или тремя парами электронов, общими для двух непосредственно соединённых атомов, как, например, в этилене H2C = CH2, формальдегиде H2C = О, ацетилене HC ≡ CH, синильной кислоте Н С ≡ N (подробнее … Большая советская энциклопедия
Кратные единицы — Приставки СИ (десятичные приставки) приставки перед названиями или обозначениями единиц измерения физических величин, применяемые для формирования кратных и дольных единиц, отличающихся от базовой в определённое целое, являющееся степенью числа… … Википедия
Кратные приставки для образования производных единиц — Приставки СИ (десятичные приставки) приставки перед названиями или обозначениями единиц измерения физических величин, применяемые для формирования кратных и дольных единиц, отличающихся от базовой в определённое целое, являющееся степенью числа… … Википедия
Теория изогнутой химической связи — предложена Лайнусом Полингом на симпозиуме по теоретической органической химии, посвящённом памяти А.Кекуле (симпозиум состоялся в Лондоне в сентябре 1958 г.). В докладе Полинга дана теория двойной связи как комбинации двух одинаковых изогнутых… … Википедия
Сигма- и пи-связи — (σ и π связи) ковалентные химические связи, характеризующиеся определенней, но различной пространственной симметрией распределения электронной плотности. Как известно, ковалентная связь образуется в результате обобществления электронов… … Большая советская энциклопедия
СОПРЯЖЁННЫЕ СВЯЗИ — см. в ст. Кратные связи … Большой энциклопедический политехнический словарь
ТРОЙНЫЕ СВЯЗИ — см. Кратные связи … Естествознание. Энциклопедический словарь
Конъюгированные связи — сопряжённые связи, химические кратные (двойные или тройные) связи, разделённые одной простой связью, например . Подробнее см. Сопряжение связей … Большая советская энциклопедия
Источник
Простые и кратные связи



Простые связи имеют элементы, у которых имеется одна связь. Кратные, – у которых имеются две, три связи.
Если между двумя атомами образуется только одна общая электронная пара, то такая ковалентная связь называется простой (одинарной) связью.
π-Связи – это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов.
s-Облака не могут образовать π-связи. В образовании π-связей могут участвовать p- и d-облака. Например, π-связь образуется при перекрывании двух p-облаков.
π-Связь образуется в тех случаях, когда между двумя атомами возникает две или три общие электронные пары.
Число общих электронных пар между связанными атомами характеризует кратность связи.
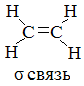
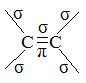
Если связь между двумя атомами образована двумя общими электронными парами, то такая связь называется двойнойсвязью. Любая двойная связь состоит из одной σ-связи и одной π-связи.
Если связь между двумя атомами образована тремя общими электронными парами, то такая связь называется тройнойсвязью. Любая тройная связь состоит из одной σ-связи и двух π-связей.
Двойные и тройные связи имеют общее название: кратные связи.
2. Непредельные углеводороды. Этиленовые углеводороды (Алкены) CnH2n
Алкены – это нециклические угдеводороды, в молекулах, которых два атома углерода находятся в состоянии sp 2 -гиридизации и связаны друг с другом двойной связью.
SP 2 -гибридизация, валентный угол = 120
l = 0,134 нм (длина связи)
В молекулах этилена между атомами углерода двойная связь π и σ. σ-связь образуется гибридными облаками. σ-связь образована p-электронами (непрочная связь).
Источник
Что значит активные кратные связи
Ковалентная химическая связь имеет определенные качественные или количественные характеристики. К ним относятся:
4.1. Насыщаемость ковалентной связи
Атом не может образовать бесконечное число ковалентных связей, оно вполне определенное. Максимальное число связей, которое может образовать атом, определяется числом его валентных электронных орбиталей. Это и определяет насыщаемость ковалентной связи.
4.2. Энергия связи
Энергия связи – это энергия, которая выделяется при образовании молекулы из одиночных атомов. Энергия связи отличается от ΔHобр. Теплота образования – это энергия, которая выделяется или поглощается при образовании молекул из простых веществ. Так:
N + O → NO — 89,96 кДж/моль – Е св.
Для двухатомных молекул энергия связей равна энергии диссоциации, взятой с обратным знаком: например в молекуле F2 энергия связи между атомами F-F равна — 150,6 кДж/моль.
Для многоатомных молекул с одним типом связи, например, для молекул АВn, средняя энергия связи равна 1/n части полной энергии образования соединения из атомов. Так, энергия образования СН4 = -1661,1 кДж/моль. Так как в молекуле СН4 четыре связи, то энергия одной связи С – Н равна 415,3 кДж/моль. Исследование большого числа известных в настоящее время данных по энергиям связи показывает, что энергия связи между конкретной парой атомов часто оказывается величиной постоянной при условии, что остальная часть молекулы изменяется незначительно. Так, в насыщенных углеводородах Есв ( C – Н) = 415,3 кДж/моль, Есв ( C – С) = 331,8 кДж/моль.
Энергии связей в молекулах, состоящих из одинаковых атомов, уменьшаются по группам сверху вниз (табл. 4.1).
По периоду энергии связей растут. В этом же направлении возрастает и сродство к электрону
Энергии связей некоторых двухатомных молекул
Молекула
Есв, ккал/моль
E св, кДж/моль
Cs2
Если в молекуле соединяются более двух различных атомов, то средняя энергия связи не совпадает с величиной энергии диссоциации молекулы. Если в молекуле представлены различные типы связи, то каждому из них можно приближенно приписать определенное значение Е. Это позволяет оценить энергию образования молекулы из атомов. Например, энергию образования молекулы пентана из атомов углерода и водорода можно вычислить по уравнению:
В табл. 4.2 рассматривается взаимосвязь между энергией химической связи и свойствами веществ.
Взаимосвязь между энергией химической связи и свойствами веществ
Вид связи
Энергия связи, кДж/моль
Свойства
Ковалентная
Высокие твердость, прочность, температуры кипения и плавления
Хрупкость
Металлическая
Высокая пластичность
Водородная
Низкие твердость, прочность, температуры кипения и плавления
Вандерваальсова
4.3. Длина связи
Длина связи – это расстояние между ядрами взаимодействующих атомов. Ориентировочно оценить длину связи можно, исходя из атомных или ионных радиусов, или из результатов определения размеров молекул с помощью числа Авогадро. Так, объем, приходящийся на одну молекулу воды: 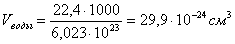
С помощью различных методов физико-химических исследований (например электронографии) определяют d более точно. Исследование длин связей показало, что для данной пары атомов в различных (сходных) соединениях длина связи остается величиной постоянной.
Из длин связей между атомами в молекуле можно вычислить ковалентные радиусы атомов. Если рассмотреть гомоядерные двухатомные молекулы с простой связью, такие как F 2 или С l 2, атомам F и С l можно приписать ковалентные радиусы простых связей, равные половине межъядерного расстояния в соответствующих молекулах. Для элементов, которые не могут образовать двухатомные молекулы с простыми связями, используют другие методы определения радиусов. Так, поскольку расстояние С—С в алмазе и множестве органических молекул найдено равным 1,54+0,01 Å, то ковалентный радиус атома углерода принимают равным 0,77. Чтобы получить ковалентный радиус атома азота, вычитают 0,77 из расстояния С—N в молекуле Н3С— NH 2, при этом получают 0,70. Этим способом можно составить таблицу ковалентных радиусов простых связей (табл. 4.3).
Некоторые ковалентные радиусы простых связей
Ковалентный радиус, Å
Ковалентный радиус, Å
Также можно получить и радиусы кратных связей. Например, для тройной связи радиусы атомов углерода и азота можно вычислить из длин связей в Н—С º С—Н и N º N ; они равны 0,60 и 0,55, причем для длины связи C º N они дают величину 1,15 по сравнению с 1,16, полученной экспериментально. Можно сделать вывод, что чем выше порядок связи между атомами, тем она короче (см. табл. 4.4).
На длину связи в значительной мере влияет и гибридизация. Так, определено, что расстояние С—С, равное 1,54, относится к связи между двумя s р 3 -гибридизированными атомами, а расстояние С=С обычно относят к связи между двумя s р 2 -гибридизированными атомами углерода, в то время как связь C º C , главным образом, наблюдается между sp -гибридизированными углеродными атомами.
Длина связи, ´ 10 -10 м
Длина связи, ´ 10 -10 м
Поскольку 2 s -орбиталь углерода имеет меньший средний радиус, чем 2р-орбиталь, следует ожидать, что чем больше s -характер используемой орбитали, тем короче должно быть межъядерное расстояние, при котором будет наблюдаться лучший баланс между перекрыванием и отталкиванием в σ-связи. Было установлено, что в случае простой связи радиусы атома углерода в разных состояниях гибридизации равны: sp 3 — 0,77; sp 2 — 0,74 и sp — 0,70.
4.4. Кратность связи
Кратность связи определяется количеством электронных пар, участвующих в связи между атомами. Химическая связь обусловлена перекрыванием электронных облаков. Если это перекрывание происходит вдоль линии, соединяющей ядра атомов, то такая связь называется σ-связью. Она может быть образована за счет s – s электронов, р – р электронов, s – р электронов. Химическая связь, осуществляемая одной электронной парой, называется одинарной.
Если связь образуется более чем одной парой электронов, то она называется кратной.
Кратная связь образуется в тех случаях, когда имеется слишком мало электронов и связывающихся атомов, чтобы каждая пригодная для образования связи валентная орбиталь центрального атома могла перекрыться с какой-либо орбиталью окружающего атома.
Поскольку р-орбитали строго ориентированы в пространстве, то они могут перекрываться только в том случае, если перпендикулярные межъядерной оси р-орбитали каждого атома будут параллельны друг другу. Это означает, что в молекулах с кратной связью отсутствует вращение вокруг связи.
4.5. Полярность связи
Если двухатомная молекула состоит из атомов одного элемента, как, например, молекулы Н2, N2, Cl 2 и т. п., то каждое электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распределяется в пространстве симметрично относительно ядер обоих атомов. В подобном случае ковалентная связь называется неполярной или гомеополярной. Если же двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает асимметрия в распределении заряда. В таких случаях ковалентная связь называется полярной или гетерополярной.
Для оценки способности атома данного элемента оттягивать к себе общую электронную пару пользуются величиной относительной электроотрицательности. Чем больше электроотрицательность атома, тем сильнее притягивает он общую электронную пару. Иначе говоря, при образовании ковалентной связи между двумя атомами разных элементов общее электронное облако смещается к более электроотрицательному атому, и в тем большей степени, чем больше различаются электроотрицательности взаимодействующих атомов. Значения электроотрицательности атомов некоторых элементов по отношению к электроотрицательности фтора, которая принята равной 4, приведены в табл. 4.5.
Как показывает табл. 4.5, электроотрицательность закономерно изменяется в зависимости от положения элемента в периодической системе. В начале каждого периода находятся элементы с наиболее низкой электроотрицательностью — типичные металлы, в конце периода (перед благородными газами) — элементы с наивысшей электроотрицательностью, т. е. типичные неметаллы.
У элементов одной и той же подгруппы электроотрицательность с ростом заряда ядра проявляет тенденцию к уменьшению. Таким образом, чем более типичным металлом является элемент, тем ниже его электроотрицательность; чем более типичным неметаллом является элемент, тем выше его электроотрицательность.
Относительная электроотрицательность элементов
Смещение общего электронного облака при образовании полярной ковалентной связи приводит к тому, что средняя плотность отрицательного электрического заряда оказывается выше вблизи более электроотрицательного атома и ниже — вблизи менее электроотрицательного. В результате первый атом приобретает избыточный отрицательный, а второй — избыточный положительный заряд; эти заряды принято называть эффективными зарядами атомов в молекуле.
Так, в молекуле хлористого водорода общая электронная пара смещена в сторону более электроотрицательного атома хлора, что приводит к появлению у атома хлора эффективного отрицательного заряда, равного 0,17 заряда электрона, а у атома водорода такого же по абсолютной величине эффективного положительного заряда. Следовательно, молекула НС1 является полярной молекулой. Ее можно рассматривать как систему из двух равных по абсолютной величине, но противоположных по знаку зарядов, расположенных на определенном расстоянии друг от друга.
4.6. Типы ковалентных молекул
В зависимости от характера распределения электронной плотности молекулы могут быть неполярными и полярными. В неполярных молекулах центры тяжести положительных и отрицательных зарядов совпадают. Полярные молекулы являются диполями, т. е. системами, состоящими из двух равных по величине и противоположных по знаку зарядов (+ q и — q ), находящихся на некотором расстоянии ℓ друг от друга. Расстояние между центрами тяжести положительного и отрицательного зарядов называется длиной диполя. Полярность молекулы, как и полярность связи, оценивают величиной ее электрического момента диполя µ, представляющего собой произведение длины диполя ℓ на величину электрического заряда: µ = ℓ q .
Длина диполя имеет значение порядка диаметра атома, т. е. 10 -10 м, а заряд электрона 1,6·10 -19 Кл, поэтому электрический момент диполя выражается величиной порядка 10 -29 Кл·м.
Дипольный момент молекулы служит количественной мерой ее полярности. Дипольные моменты молекул обычно измеряют в дебаях ( D ): 1 D = 3,34·10 -30 Кл·м.
Электрический момент диполя молекулы представляет собой векторную сумму моментов всех связей и несвязывающих электронных пар в молекуле. Результат сложения зависит от структуры молекулы.
Молекула тем более полярна, чем больше смещена общая электронная пара к одному из атомов, т. е. чем выше эффективные заряды атомов и чем больше длина диполя. Поэтому в ряду сходно построенных молекул дипольный момент возрастает по мере увеличения разности электроотрицательностей атомов, образующих молекулу. Например, дипольные моменты НС1, НВ r и HI равны, соответственно, 1,04; 0,79 и 0,38 D , что связано с уменьшением разности электроотрицательностей атомов при переходе от НСl к НВ r и HI (см. табл. 4.5).
Многоатомные молекулы также могут быть неполярными при симметричном распределении зарядов, или полярными – при асимметричном распределении зарядов. В последнем случае дипольный момент молекулы будет отличаться от нуля. Каждой связи в многоатомной молекуле можно приписать определенный дипольный момент, характеризующий ее полярность; при этом следует принимать во внимание не только величину дипольного момента, но и его направление, т. е. рассматривать дипольный момент каждой связи как вектор. Тогда суммарный дипольный момент молекулы в целом можно считать равным векторной сумме дипольных моментов отдельных связей. Дипольный момент обычно принято считать направленным от положительного конца диполя к отрицательному.
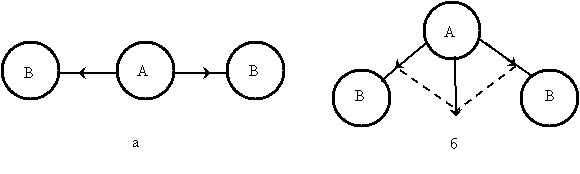
Рис. 4.1. Дипольные моменты отдельных связей в молекулах типа АВ2 различного строения: а – линейное строение, б – угловое строение
На рис. 4.1 изображены схемы возможного строения молекулы типа АВ2; векторы дипольных моментов отдельных связей А—В показаны стрелками, направленными от А к В. При линейном строении (рис. 4.1, а) равные по величине дипольные моменты двух связей А—В противоположны по направлению. Следовательно, дипольный момент такой молекулы будет равен нулю. В случае углового строения (рис. 4.1, б) векторная сумма дипольных моментов двух связей А—В отличается от нуля; такая молекула обладает дипольным моментом и является полярной. Поэтому наличие или отсутствие дипольного момента у молекулы типа АВ2 позволяет сделать вывод о ее геометрическом строении.
Например, молекула СО2 имеет симметричное линейное строение:
Поэтому, хотя связи С=О и имеют сильно полярный характер, вследствие взаимной компенсации их электрических моментов диполя молекула СО2 в целом неполярна (µ = 0). По этой же причине неполярны высокосимметричные тетраэдрические молекулы СН4, CF 4, октаэдрическая молекула SF 6 и т. д. Напротив, в угловой молекуле Н2О полярные связи О—Н располагаются под углом 104,5°. Поэтому их моменты взаимно не компенсируются, и молекула оказывается полярной (µ = 0.61·10 -29 Кл·м):
Отсутствие дипольного момента свидетельствует о высоко симметричной структуре молекулы, наличие электрического момента диполя — о несимметричности структуры молекулы (табл. 4.6).
Полярность молекул оказывает заметное влияние на свойства образуемых ими веществ. Полярные молекулы стремятся ориентироваться по отношению друг к другу разноименно заряженными концами. Следствием такого диполь-дипольного взаимодействия является взаимное притяжение полярных молекул и упрочнение связей между ними. Поэтому вещества, образованные полярными молекулами, обладают, как правило, более высокими температурами плавления и кипения, чем вещества, молекулы которых неполярны.
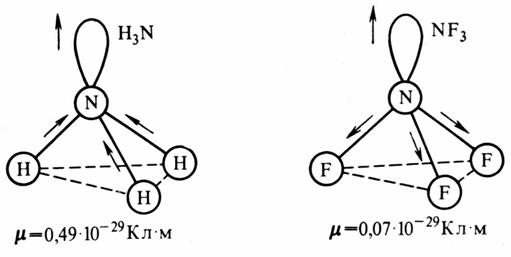
На величину электрического момента диполя молекулы сильно влияют несвязывающие электронные пары. Например, молекулы H 3 N и NF 3 имеют одинаковую тригонально-пирамидальную форму, полярность связей N—Н и N— F также примерно одинакова, однако электрический момент диполя Н3 N равен 0,49·10 -29 Кл·м, a NF 3 — всего 0,07·10 -29 Кл·м.
Строение и ожидаемая полярность молекул
Пространственная конфигурация
полярность
Примеры
Рис. 4.2. Сложение электрических моментов диполя связывающей и несвязывающей электронных пар молекул H 3 N и NF 3
Это объясняется тем, что в Н3 N направление электрического момента диполя связывающей N—Н и несвязывающей электронной пары совпадает и при векторном сложении обусловливает большой электрический момент диполя. Наоборот, в NF 3 моменты связей N—F и электронной пары направлены в противоположные стороны, поэтому при сложении они частично компенсируются (рис. 4.2). Значения электрических моментов диполя некоторых молекул приведены в табл. 4.7.
Электрический момент диполя
Молекула
µ, × 10 -30 ,Кл × м
Молекула
µ, × 10 -30 ,Кл × м
Молекула
µ, × 10 -30 ,Кл × м
Зная экспериментальные значения электрического момента диполя, можно рассчитать полярность связей и эффективные заряды атомов. В простейшем случае двухатомных молекул можно приближенно считать, что центры тяжести зарядов совпадают с ядрами, т. е. ℓ равно межъядерному расстоянию или длине связи. Так, в молекуле НС1 d HCl = 0,127 нм. Если бы хлорид водорода был чисто ионным соединением ( q равно заряду электрона), то его электрический момент диполя был бы равен μ = 1,6·10 -19 Кл · 1,27·10 -10 м = = 2,032·10 -29 Кл·м.
В действительности же момент диполя газообразного хлорида водорода равен 0,347·10 -29 Кл·м, что составляет примерно 18 % от рассчитанного μ в предположении ионного характера связи. Таким образом, эффективные заряды на атомах H и Cl в молекуле НС1 равны ±0,18 абсолютного заряда электрона.
4.7. Вопросы и задания
4.7.1. Ковалентный радиус атома брома 1,14·10 -10 м. Рассчитайте приблизительные ядерные расстояния в молекулах брома и бромоводорода, если ковалентный радиус атома водорода равен 0,30·10 -10 м.
4.7.2. Ковалентный радиус атома водорода равен 0,30·10 -10 м. Вычислите ковалентные радиусы атомов фтора, хлора и иода, если межъядерные расстояния равны (м): dH-F = 0,92·10 -10; dH — Cl 1,28·10 -10 ; dH — I = 1,62·10 -10 .
4.7.3. Вычислите длину связи С—С l в СС l 4 по следующим данным: длины связей С—С и С l —С l равны соответственно 1,54·10 -10 и 1,99·10 -10 м.
4.7.4. Длина связи С—С равна 1,54·10 -10 м. Чему равна длина связи Н— S в H 2 S и С—Н в СН4, если межъядерное расстояние в молекуле Н2 равно 0,741·10 -10 м?
4.7.5. Вычислите длины связей Н—О в Н2О и Н—N в NH 3, если межъядерные расстояния в молекулах Н2, O 2 и Na соответственно равны (м): 0,74·10 -10 , 1,20·10 -10 , 1,09·10 -10 .
4.7.6. Произведите приближенную оценку длины связей в молекулах NО и SO , если межъядерные расстояния в молекулах N 2, О2 и S 2 соответственно равны (м): 1,09·10 -10 , 1,20·10 -10 , 1,92·10 -10 .
4.7.7. Длина одинарной связи d В-В равна 1,76·10 -10 м. Так как отношения d Э-Э : d Э=Э и d Э=Э : d Э≡Э у разных элементов приблизительно одинаковы, вычислите длины кратных связей В=В, В≡В, используя соответствующие данные для углерода.
4.7.8. Эффективные радиусы ионов Zn 2+ и S 2- соответственно равны (м): 0,831·10 -10 и 1,82·10 -10 . Вычислите константу решетки кристаллического сульфида цинка.
4.7.9. Рассчитайте эффективный радиус иона натрия в кристалле NaF , если константа решетки NaF равна 2,31·10 -10 м, радиус иона F — равен 1,33·10 -10 м.
4.7.10. Вычислите энергию s — р-ковалентной связи в молекуле Н—С1, если стандартная энтальпия образования НС l (г) равна 92,3 кДж/моль, а энергии связей Н—Н и С1—С1 соответственно равны (кДж/моль): -435,9 и -242,3.
4.7.11. Рассчитайте изменение энтальпии в процессе образования оксида азота (II), если энергии кратных связей азот — азот, кислород — кислород и азот — кислород соответственно равны (кДж/моль): -945,6, -498,7 и -631,0.
4.7.12. Вычислите энергию σ-связи С—С, если стандартная теплота образования С2Н6 из газообразных углерода и водорода равна -2815,0 кДж/моль, а энергия σ-связи С—Н равна -411,3 кДж/моль.
4.7.13. Определите стандартную теплоту образования из простых веществ этилена, если энергии связей Н—Н, С—Н и С=С соответственно равны (кДж/моль): — 435,9, — 587,8, а теплота возгонки графита равна +715,88 кДж/моль.
4.7.14. Вычислите среднюю энергию связи Н— Se и Н—Те для соединений H 2 Se и Н2Те, если стандартные теплоты образования этих соединений соответственно равны 85,77 и 154,39 кДж/моль. Энергия диссоциации H 2 равна 435,9 кДж/моль.
4.7.15. Для одинарной ковалентной связи между двумя атомами А и В дополнительная энергия связи Есв., обусловленная ее частично ионным характером, по Полингу приблизительно оценивается формулой: 100[ЭО(А) – ЭО(В)] 2 кДж, т.е. она пропорциональна квадрату разности электроотрицательностей данных атомов. Вычислите дополнительную энергию связей Н- I и H — Cl за счет частичного ионного характера связей, если ЭО(Н) = 2,1, ЭО( Cl ) = 3,0, ЭО( I ) = 2,6. Какое из этих двух соединений прочнее и реакция его образования более экзотермична?
4.7.16. Энергия диссоциации HI равна 298,4 кДж/моль. Можно ли разложить HI на элементы при облучении ультрафиолетовым светом (λ = 2·10 -7 м)? Какую энергию надо затратить, чтобы разложить 5·10 -7 г HI ?
4.7.17. К каким атомам смещены связывающие электронные облака в следующих молекулах: а) НС1; б) НВг; в) HI ; г) NaH ; д) КН; е) ВеО; ж) N0; з) BN ; и) C 1 F ; к) ClBr ; л) MgS ; м) BeCl 2; н) ВВ r 3; о) СО2; п) OF 2; р) MgF 2; с) А1С13?
4.7.18. Рассчитайте эффективные заряды на атомах следующих молекул: a ) BrCl ; б) BrF ; в) C 1 F ; г) НС1; д) НВ r ; е) HI ; ж) LiBr ; з) LiF ; и) NaCl ; к) Nal ; л) NO ; м) Н2О ( NH 3 ( HNH = 107°).
4.7.19. Как изменяется полярность в ряду молекул: а) HF ; НС1; НВ r ; HI ; б) NH 3; РН3; А sH 3?
4.7.20. Почему электрический момент диполя молекулы дихлорбензола равен нулю, а молекулы дигидроксибензола (гидрохинона) равен 5,48·10 -30 Кл·м?
4.7.21. Изомеры С2Н2С l 2 имеют следующие электрические моменты диполей: 0, 4,01·10 -30 и 6,34·10 -30 Кл·м. Укажите формулы этих изомеров.
4.7.22. Электрические моменты диполя изомеров трихлорбензола равны 0, 4,21·10 -30 и 7,78·10 -30 Кл·м. Укажите эти изомеры.
4.7.23. Молекула NF 3 имеет меньший электрический момент диполя, чем молекула NH 3 (соответственно 0,70·10 -30 и 4,88·10 -30 Кл·м). Чем объясняется такое различие в значениях моментов этих молекул?
4.7.24. Какая из молекул, CS 2 или H 2 S , должна иметь больший дипольный момент? Объясните ответ.
4.7.25. Дипольный момент молекулы H 2 O равен 1,85 D , а у молекулы F 2 O он равен всего 0,297 D , хотя валентные углы в обеих молекулах приблизительно одинаковы. Объясните причину этого.
4.7.26. На основе электронного строения указанных ниже молекул в рамках модели локализованных орбиталей объясните значения их дипольных моментов: NH 3 μ = 1,47 D ; PH 3 μ = 0,55 D ; NF 3 μ = 0,23 D .
4.7.27. Какая молекула, аммиак или арсин имеет больший дипольный момент? Почему?
4.7.28. Почему молекула CCl 4 неполярная, а CH 3 Cl – полярная?
4.7.29. а)длина связи в молекуле НВ r равна 1,41 Å. Вычислите дипольный момент (в дебаях) пары зарядов противоположного знака величиной 1,60·10 -19 Кл (равной заряду электрона), удаленных друг от друга на это расстояние;
б) экспериментально наблюдаемый дипольный момент HBr равен 0,79 D . Объясните, почему дипольный момент, найденный вами при ответе на вопрос (а), больше дипольного момента, наблюдаемого для HBr .
Источник