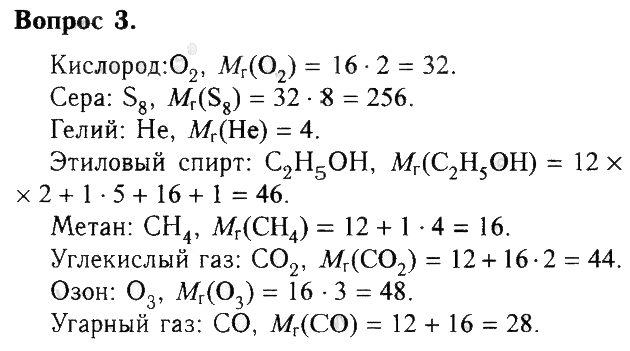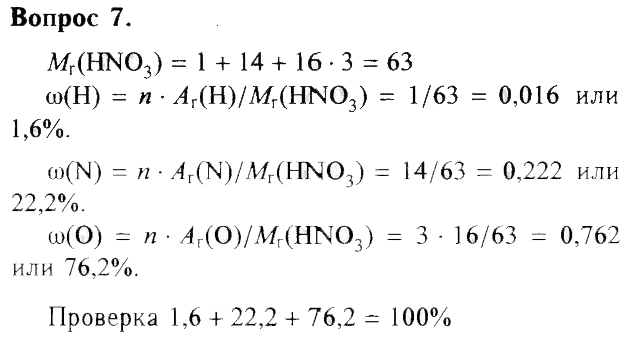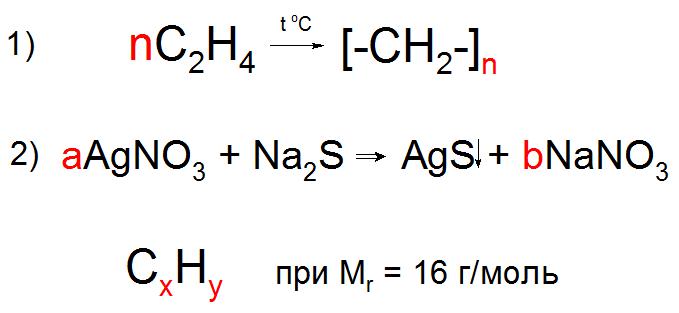- Что означают записи: 3H; 2H2O; 5O2.
- Кислород: химия кислорода
- Кислород
- Положение в периодической системе химических элементов
- Электронное строение кислорода
- Физические свойства и нахождение в природе
- Способы получения кислорода
- Соединения кислорода
- Химические свойства
- Что означают записи 3H, 2H2O, 5O2 и какую информацию получают с их помощью
- Числа в выражениях и их возможные виды
- Буквенные выражения и их информативность
- Подстрочные символы и их обозначения
Что означают записи: 3H; 2H2O; 5O2.
Вопросы:
1. Что означают записи: 3H; 2H2O; 5O2?
2. Запишите формулу сахарозы, если известно, что в состав её молекулы входят двенадцать атомов углерода, двадцать два атома водорода и одиннадцать атомов кислорода.
3. Используя рисунок 2 (см. с. 5), запишите формулы веществ и рассчитайте их относительные молекулярные массы.
4. Какой форме существования химического элемента кислорода соответствует каждая из следующих записей: 3O; 5O2; 4CO2?
5. Почему относительная атомная масса элемента и относительная молекулярная масса вещества не имеют единиц измерения?
6. B каком из веществ, формулы которых SO2 и SO3, массовая доля серы больше? Ответ подтвердите расчетами.
7. Вычислите массовые доли элементов в азотной кислоте HNO3.
8. Дайте полную характеристику глюкозы (C6H12O6, используя пример описания углекислого газа CO2 (см. с. 42).
Ответы:

Источник
Кислород: химия кислорода
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -183 о С.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
- Разложение некоторых кислородосодержащих веществ:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
Основные степени окисления кислород +2, +1, 0, -1 и -2.
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами , и с неметаллами . Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо , в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды . При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения ( сероводород, аммиак, метан, силан гидриды . При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора ( сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления ( оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например , кислород окисляет гидроксид железа (II):
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Источник
Что означают записи 3H, 2H2O, 5O2 и какую информацию получают с их помощью
Тем, кто только начинает знакомиться с химией и присущими ей видами обозначения различных веществ и уравнений, необходимо знать определенные правила, применяемые в международной практике. Следующие примеры помогут разобраться, что означают записи 3H, 2H2O, 5O2 и какую информацию получают из данного набора цифр и букв.
Числа в выражениях и их возможные виды
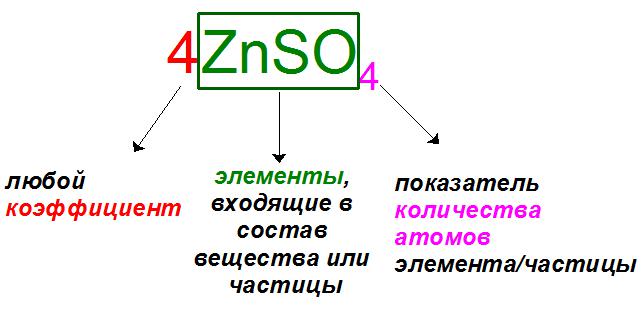
Если читать выражения слева направо, то первыми всегда записываются так называемые коэффициенты. Эти показатели характеризуют количество частиц или вещества (атомов, молекул, ионов, моль), участвующих в реакции. Коэффициенты принято записывать арабскими цифрами: обычно это все положительные натуральные числа (1, 2, 3…), если только речь не идет об эквивалентах, где они могут записываться как дробные (1/2, 1/3, 1/4…).
Например, цифры в записях 3H, 2H2O и 5O2 в химии означают, что нам даны 3 атома водорода H, 2 и 5 молекул воды H2O и газообразного кислорода O2 соответственно. Следует обратить внимание, что первый пример является неверным, так как атомарный H в природе не существует, а присутствует только в виде молекулы H2 или же в растворе в качестве положительно заряженного иона H + .
Если в уравнении частица или вещество участвует в единственном числе, например ион хлора 1Cl — или молекула серной кислоты 1H2SO4, коэффициент «1» опускают и записывают без него: Cl — и H2SO4.
В случае записи уравнений в общем виде, характерном для реакции полимеризации, поликонденсации, электролиза и других химических взаимодействий, в условиях задачи могут использовать буквенные обозначения количества частиц или веществ, вроде n или x, y, z . Коэффициент n обычно обозначает любое натуральное число, он обязательно должен присутствовать в обеих частях уравнения (пример 1), а любые другие буквы английского алфавита обозначают неизвестные, которые необходимо найти по условию задачи (пример 2).
Буквенные выражения и их информативность
Символы английского алфавита в записях 3H, 2H2O и 5O2 означают, что в веществах содержатся определенные химические элементы, а также их соединения. Такую запись без цифр спереди называют химической формулой. Так, записи 3H + , 2H2O и 5O2 означают, что, допустим, в реакции участвуют 3 иона водорода, 2 и 5 молекул воды и кислорода соответственно. Но такого рода выражения также могут быть указаны в тексте и в обособленном от уравнений виде в качестве описания реагентов или продуктов реакции.
Подстрочные символы и их обозначения
В состав веществ может входить множество атомов отдельно взятых элементов, а также сами соединения иметь повторяющиеся звенья в зависимости от их природы и структуры. Для указания количества тех или иных частиц используются подстрочные цифры или буквы, имеющие тот же характер обозначения, что и основные коэффициенты. Например, нижние числа в записях 3H + , 2H2O и 5O2 означают, что подобные символы могут быть только в комплексных ионах типа [Cu(NH3)4] 2+ , а в молекулах таких веществ, как вода и кислород, содержатся по 2 атома водорода и кислорода.
Буквы применяют в подстрочных символах в качестве обозначений некоторого количества атомов или звеньев (n), а также неизвестного количества атомов в соединениях при составлении задач (a, b, x, y).
Источник