Больной экстубирован что значит
Послеоперационное угнетение дыхания: физиологические механизмы и методы коррекции.
Физиологические механизмы послеоперационного угнетения дыхания
Причины дыхательной недостаточности (ДН) в послеоперационном периоде многочисленны и разнообразны. Они могут быть классифицированы следующим образом:
- Центральное угнетение дыхания (действие анестетиков и др. препаратов)
- Остаточная миоплегия после действия миорелаксантов
- Ограничение вентиляции, связанное с самим оперативным вмешательством (боль, поражение легких операционным стрессом, пневмотораксом, пневмоперитонеумом и т.д.)
- Осложнения анестезиологического пособия (последствия травматичной интубации, ларингоспазм, аспирационный синдром, ошибки при проведении ИВЛ, трансфузионные осложнения и др.)
- Декомпенсация ДН у больных с сопутствующими заболеваниями дыхания и кровообращения (кардиогенный отек легких, бронхообструктивный синдром и др.)
- Нарушение дренирования мокроты, связанное с иммобилизацией больного, болью и др. В этом сообщении рассматривается только угнетение дыхания анестетиками, седативными препаратами и другими депрессантами.
Центральное угнетение дыхания (ЦУД)
Под посленаркозным ЦУД следует понимать временное угнетение вентиляции, связанное с остаточным действием вводимых во время анестезиологического пособия седативных препаратов и анестетиков. Под их влиянием повышается порог чувствительности дыхательного центра к изменениям газового состава крови и другим стимулам. Угнетение нейрореспираторного драйва (НРД) проявляется не только слабостью мышц вдоха. Снижается и тонус мышц глотки и рта, что может привести к обструктивному апноэ, если больной экстубирован.
ЦУД наиболее выражено сразу после операции. Однако, если седативные или наркотические препараты вводились в самом конце оперативного вмешательства, то угнетение дыхания может иметь отсроченный характер. Кроме того, с окончанием операции ослабляется стрессовая стимуляция ЦНС, что тоже влияет на ЦУД. Иногда экстубация может привести к снятию стимулирующего влияния интубационной трубки и опасной гиповентиляции. Больные с ожирением, синдромами сонного апноэ часто очень чувствительны к седативным препаратам и входят в группу повышенного риска расстройств дыхания в посленаркозном периоде.
Учитывая вышеизложенное, дозы анестетиков, время и способ их введения должны тщательно регистрироваться в ходе наркоза.
В дисфункции дыхательных мышц играют роль не только центральные депрессанты и миорелаксанты, но и некоторые другие вводимые на их фоне препараты (напр. лазикс), физиологическое состояние организма (ацидоз, гипокалиемия), а также направление и длина хирургического разреза.
Независимо от механизма развития, основным физиологическим следствием ЦУД является нарушение адекватной альвеолярной вентиляции, гипоксемия и респираторный ацидоз. Ухудшаются вентиляционно-перфузионные отношения, увеличивается доля мертвого пространства в дыхательном объеме. Все это приводит к нарастанию артериальной гипоксемии и гиперкапнии. Компенсаторные возможности организма в этот период ограничены, поэтому изменения газового состава крови наступают быстро и в скором времени влекут за собой угрожающие расстройства гемодинамики и сердечного ритма.
Следовательно, у всех больных с ЦУД в ближайшем послеоперационном периоде необходимо проведение искусственной или вспомогательной вентиляции легких при тщательном мониторинге показателей вентиляции и гемодинамики в специально оборудованной восстановительной палате в составе операционного блока, если характер операции и состояние больного не требуют более длительного его нахождения в отделении интенсивной терапии. Время, в течение которого у больного происходит восстановление самостоятельного дыхания и сознания, зависит от его исходного состояния, глубины наркоза, фармакокинетики введенных препаратов и их взаимодействия и может занимать от нескольких минут до нескольких часов.
В последнее время в клиническую практику широко входят различные препараты, ослабляющие или полностью блокирующие действие наркотических аналгетиков (налоксон), транквилизаторов (флумазенил) и миорелаксантов (прозерин). Они позволяют в короткие сроки восстановить сознание и дыхание больного и экстубировать его.
Давно известна способность антихолинэстеразных препаратов восстанавливать проводимость в нервно-мышечном синапсе во время пролонгированной миоплегии, обусловленной остаточным действием недеполяризующих миорелаксантов. После их применения на это может понадобиться до 20-30 минут, в зависимости от глубины миоплегии, уровня метаболизма, температуры тела и др. Следует помнить, что антихолинэстеразные препараты способны спровоцировать бронхиолоспазм, вызвать опасные нарушения сердечного ритма, и эти эффекты далеко не всегда поддаются терапии холиноблокаторами.
Для купирования действия наркотических аналгетиков применяются специфические антагонисты опиоидных рецепторов налоксон и налтрексон. Действуя с одинаковой силой на все опиоидные рецепторы, налоксон не только устраняет наркотическую депрессию дыхания, но и полностью купирует аналгезию. Это может повлечь за собой мощную реакцию на болевой синдром, спровоцировать нарушения кровообращения и дыхания, вылечить которые уже гораздо сложнее. Кроме того, из-за относительно непродолжительного действия налоксона возможен эффект ренаркотизации.
Учитывая эти факторы, мы в большинстве случаев являемся сторонниками плавного выхода из наркоза, как наиболее безопасного пути для пациента и лечащего врача.
В последнее время, однако, отмечается неуклонный рост хирургической активности, появление разнообразных эндоскопических операций, а также расширение показаний для диагностических и лечебных манипуляций, выполняемых в стационаре или амбулаторно под наркозом или седатацией. Длительное наблюдение таких больных в послеоперационном периоде при большом их потоке сковывает значительные силы персонала и материальных средств, не только увеличивая стоимость лечения больного, но и повышая вероятность ошибки врачей и сестер. После многих из них быстрое восстановление сознания и дыхания весьма желательно и достаточно безопасно при соблюдении необходимых условий.
Клиническая фармакология флумазенила
Более 10 лет в медицинской практике используется пока единственный в своем роде антагонист бензодиазепиновых рецепторов флумазенил.
Флумазенил был синтезирован в 1979 году. В клинике применяется с 1986 года. В настоящее время выпускается под названиями Anexate, Lanexate, Romazicon. В 1988 году фармацевтическая фирма Hoffmann-LaRoche за внедрение препарата анексат была удостоена престижной международной премии в области фармакологии и биотехнологии Prix Galion.
Флумазенил представляет собой водорастворимое соединение имидазобензодиазепин, которое имеет высокую степень сродства к ГАМКА- эргическим рецепторам головного мозга. Механизм его действия прямо противоположен действию всех известных бензодиазепинов и превосходит их по силе. Флумазенил оказывает тормозящее влияние на проникновение ионов хлора в нейроны и, как следствие, устраняет практически все центральные эффекты бензодиазепинов (диазепам, мидазолам и др.), что, правда, зависит от введенной дозы препарата. Например, для снятия гипнотического эффекта атарактиков требуются меньшие дозы флумазенила (0,25-0,6 мг), чем для полного устранения их анксиолитического, противосудорожного и амнестического действия ( до 15 мг).
При внутривенном введении флумазенила эффект развивается через 1 минуту с пиком действия через 6-10 мин и продолжается в течение 30-40 мин. Период полувыведения из организма составляет около 60 мин. Препарат связывается с белками плазмы на 50%, практически полностью разрушается в печени. Почечный клиренс, а также пол и возраст больного не имеют значения в его метаболизме.
Вводится флумазенил внутривенно, обычно дробно по 0,25-0,3 мг в течение
10-15 сек. Эти дозы повторяют через 30-60 секунд до получения желаемого эффекта. В отдельных случаях флумазенил можно вводить капельно в виде инфузии. Флумазенил мало- или практически нетоксичен, его побочные эффекты главным образом связаны с устранением действия бензодиазепинов. Описанный эффект реседации обычно спустя час после введения флумазенила скорее наблюдается при мощной передозировке бензодиазепинов, что возможно в практике интенсивной терапии (лечение отравлений, длительная седатация больных) и менее вероятно в анестезиологии. Резкое устранение влияния атарактиков может повлечь за собой снятие их анксиолитического действия, усиленный выброс катехоламинов, рост артериального давления и нарушения сердечного ритма.
Флумазенил способен провоцировать судорожные припадки у эпилептиков, получавших диазепам, и вызывать рост внутричерепного давления у больных с патологией ЦНС.
Последние годы ведутся тщательные исследования эффективности этого препарата у больных с различными патологиями. В интенсивной терапии отмечается (правда, далеко не всеми) его положительный эффект у больных в печеночной и алкогольной коме.
Наибольшее распространение флумазенил получил в анестезиологической практике. Продолжается изучение его действия после различных комбинаций с другими препаратами для внутривенной анестезии, у разных категорий больных после больших и малых оперативных и диагностических вмешательств.
В нашем отделении выполнено исследований препарата анексат у больных в возрасте от до после лапароскопической холецистэктомии, проведенной под атарал- или нейролептаналгезией. Отобранные для исследования пациенты не страдали сопутствующей или предшествующей патологией дыхания. Перед операцией у всех больных было получено информированное согласие на введение им анексата в посленаркозном периоде.
Грубая оценка характера дыхательных расстройств при поступлении больного в палату включала наблюдение за дыхательными экскурсиями грудной клетки и живота, аускультацию, оценку уровня сознания и мышечного тонуса. Более точная дифференцировка производилась с помощью измерения нейрореспираторного драйва, показателей механики дыхания и газового состава выдыхаемого воздуха. Регистрировались также частота сердечных сокращений (ЧСС) и артериальное давление (АД).
Исследование функции внешнего дыхания и определение степени и вида посленаркозной депрессии проводились на легочном компьютере UTS фирмы «Jeger» и мониторе Capnomac Ultima фирмы «Datex». Все исследуемые больные в послеоперационном периоде находились на принудительной вентиляции (в случае апноэ) и вспомогательной вентиляции поддержкой давлением (ВПД) (в случае гиповентиляции) с помощью аппарата Puritan-Bennett 7200ае.
ВПД является относительно новым и модным режимом вспомогательной вентиляции. В этом режиме аппарат помогает каждому вдоху пациента, доводя давление в его дыхательных путях до установленного врачом уровня и дополняя дыхательный объем. При этом почти все компоненты дыхательного паттерна и минутная вентиляция остаются под контролем больного, если у последнего сохранен нейрореспираторный драйв, достаточный для включения триггерной системы аппарата ИВЛ.
Мы подбирали давление поддержки в соответствии с дыхательным объемом и частотой дыхания под контролем концентрации углекислого газа в конечной порции выдыхаемого газа. Практически ни в одном случае оно не превышало 15 см Н2О. Чувствительность триггера во всех исследованиях устанавливалась 0,5 см Н2О. Экстубация производилась при поддержке 8-10 см Н2О, если больной был в сознании, его дыхательный объем составлял не менее 5-8 мл/кг, окклюзионное давление в трахее в первые 100 миллисекунд вдоха (Р100 ) было не менее 2,5 см Н2О, сатурация оксигемоглобина (SpO2) не менее 90%, а частота дыханий не меньше 12 и не больше 30 в минуту. В ходе исследования регистрировались также капнографическая кривая, отношение времени вдоха и выдоха (I:E), разница вдыхаемого и выдыхаемого газа по кислороду, аэродинамическое сопротивление дыхательных путей.
У больных с преимущественно центральной депрессией дыхания и низкой минутной вентиляцией нейрореспираторный драйв, частота дыханий и дыхательный объем были снижены или не определялись. Больные с периферическими расстройствами дыхания имели высокую частоту дыханий при малом дыхательном объеме, большое отношение времени вдоха к общей продолжительности дыхательного цикла и значительную разницу по кислороду во вдыхаемой и выдыхаемой смеси. Нейрореспираторный драйв у них был повышен.
Всем больным с низким НРД (Р100 6 см Н2О) и частота дыханий и низкий дыхательный объем. Возникавшее возбуждение приводило к рассинхронизации с аппаратом ИВЛ, увеличивались потребление кислорода и концентрация СО2, а также ЧСС и АД. После введения 10 мг валиума больные засыпали, НРД снижался на %, но не исчезал вовсе, поскольку аппарат улавливал попытку вдоха. По мере восстановления мышечного тонуса и адекватного дыхательного объема введением анексата восстанавливали сознание и почти немедленно производили экстубацию.
У двоих больных после атаралгезии в посленаркозном периоде была продленная центральная депрессия дыхания при нормальном мышечном тонусе. Введенный дважды анексат в дозе по 0,5 мг не привел ко сколько-нибудь значимому восстановлению дыхания и сознания, (Р100 увеличилось, но оставалось не выше 1,5 см Н2О, частота дыхания не более 12 в минуту) и больные в течение полутора — трех часов находилась на вспомогательной вентиляции легких. Мы не смогли сделать вывод о том, являлась ли эта депрессия следствием влияния фентанила или недостаточной эффективности анексата, но можно предположить, что введение последнего в обычных дозах после комбинации бензодиазепинов и наркотических аналгетиков не всегда может увенчаться успехом.
Наиболее чувствительным индикатором действия анексата оказался индекс Р100, который изменялся, даже если у больных сохранялась депрессия дыхания.
В целом, применение флумазенила у больных после лапароскопической холецистэктомии, выполненной после атаралгезии или сбалансированной анестезии с применением фентанила, валиума и дроперидола оказалось вполне безопасным, не приводило к расстройствам гемодинамики и у большинства позволяло ускорить экстубацию и перевод из восстановительной палаты в отделение. Известный синергизм в действии наркотических аналгетиков и бензодиазепинов на дыхательный центр может быть успешно ослаблен или ликвидирован введением флумазенила. Можно предположить, что сохраняющийся при этом аналгетический эффект опиоидов дает преимущества использованию флумазенила перед налоксоном для борьбы с ЦУД в посленаркозном периоде.
Источник
Больной экстубирован что значит
Отлучение от механической вентиляции включает в себя постепенное снятие механической вентиляции и переход от аппаратного дыхания к самостоятельному дыханию. При краткосрочной вентиляции удаление вентиляционной поддержки не представляет особого труда. Прекращение респираторной поддержки у пациентов, перенесших тяжелые заболевания, в том числе долгие периоды ИВЛ, может оказаться очень сложной задачей.
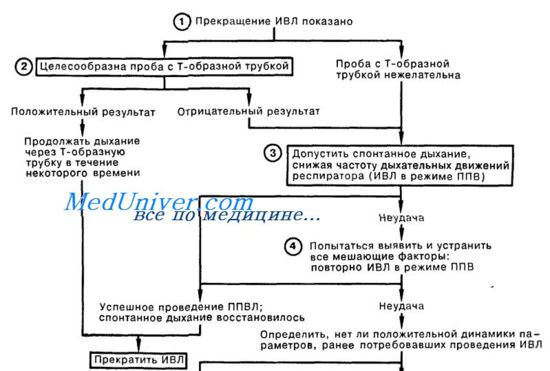
Окончательное решение, является ли пациент все еще зависимым от вентиляционной поддержки, принимается на основе пробы спонтанного дыхания (ПСД). Допустимость ПСД оценивается в зависимости от характера дыхания, газообмена, гемодинамики и самочувствия пациента.
Время продолжительности ПСД может изменяться от нескольких минут у послеоперационных пациентов с повторными пробами, до нескольких часов у пациентов после длительной механической вентиляции. Осуществление систематического ПСД в форме протокола с ограниченным графиком может способствовать быстрому получению результата у отдельных пациентов.
а) Предпосылки для отказа от вентиляции у нейрохирургических больных. При решении об отлучении от ИВЛ необходим контроль ВЧД более 24 часов. При измерении оксигенация тканей мозга должна быть в некритическом диапазоне выше 15 мм рт.ст. Общие критерии для решения о прекращении ИВЛ:
— РаО2 выше 60 мм рт. ст.
— FiO2 ниже 0,5 ПДКВ/ППДДП ниже 8 см водн. ст.
— РаСО2 должен быть равен 45 мм рт. ст.
— Нет острой полиорганной недостаточности
— Нет свежих изменений при рентгенографии органов грудной клетки.
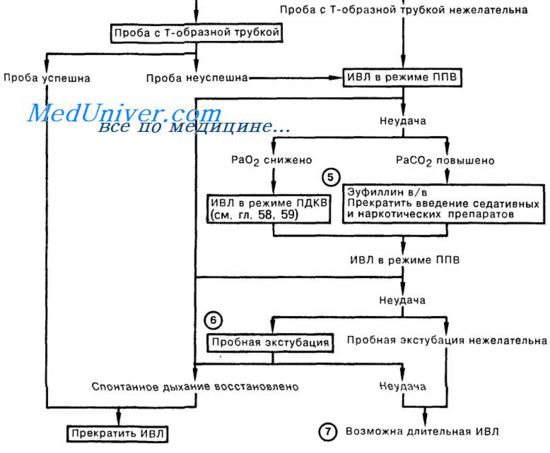
б) Методы отказа от аппарата. Отказ от аппарата с использованием Т-образного метода является классической техникой. Вентилятор отключают и подают дополнительный увлажненный дополнительный кислород. Более сложный подход для пациентов, трудно отвыкающих, когда пациент все еще находится на искусственной вентиляции легких.
Режим ППДДП обеспечивает непрерывное положительное давление в дыхательных путях (например, 5 см водн. ст.) и низкий уровень давления поддержки (например, 5-10 см водн. ст.). С поддержкой давления, при отключении, все вдохи пациента активируются и давление ограничено. Высокий уровень поддержки давления обеспечивает практический полную поддержку вентиляции.
В случае неудачи обязательная частота дыхания устанавливается на аппарате и может быть снижена постепенно, требуя более спонтанных усилий дыхания для поддержания вентиляции. При вентиляции более недели обязательная ставка снижается до одного-двух вдохов в минуту. Если пациент переносит эти условия, то может быть рассмотрено ПСД.
в) Критерии экстубации. При успешном отлучении от аппарата пациент готов к экстубации при достаточном уровне бдительности, контроле слюноотделения и адекватной защите рефлекса дыхательных путей. Чаще всего успешный отказ и экстубация совпадают по времени. Однако пациенты с поражением ствола головного мозга или нарушением сознания вполне могут дышать без респираторной поддержки, но все еще необходима временная или постоянная защита дыхательных путей с помощью трахеостомии.
Схема прекращения искусственной вентиляции легких (ИВЛ)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Посетите весь раздел посвященной «Нейрохирургии.»
Источник