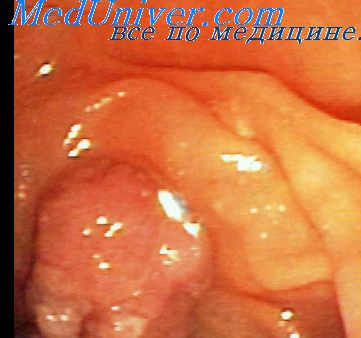
Бдс полиповидной формы что это значит
Полипы заполняют просвет ампулы БСДК или просвет интрапаниллярного отдела главного протока поджелудочной железы. БСДК умеренно увеличен и уплотнен, сохраняет обычную форму и на его верхушке имеется одно отверстие. Морфологически эти полипы идентичны гиперпластическим полипам зоны устья БСДК, отличаясь от последних только своим расположением. Развитие таких полипов можно связать с хроническим продуктивным воспалением.
Самая частая разновидность гиперпластических изменений. Железы слизистой оболочки гипернлазированы, кисгозно расширены. Гроздевидные скопления таких желез могут образовывать полиповидные выпячивания, прикрывающие просвет устья БСДК. Некоторые исследователи считают это явление обычным у лиц старше 40 лет.
Единого мнения о природе аденомиоза не существует. Относят к группе гетеротопических процессов и считают, что он развивается вследствие перемещения гиперплазированных папиллярных желез в мышечный слой сосочка. Макроскопически сосочек приобретает шаровидную форму, увеличивается в диаметре до 1,0-1,5 см. Устье определяется с трудом. Консистенция сосочка плотная, что позволяет заподозрить злокачественную опухоль. На разрезе определяется волокнистая ткань серовато-желтого цвета.
В зависимости от особенностей строения различают три гистологические формы аденомиоза большого дуоденального сосочка: узловатую, узловато-диффузную и диффузную. Эти формы аденомиоза представляют собой морфологическое выражение последовательных фаз его развития. Узловатая форма аденомиоза соответствует ранней фазе развития, когда начинается внедрение гинерплазированных папиллярных желез в мышечный слой без заметного нарушения архитектоники последнего. Дальнейшее прогрессирование процесса приводит к развитию узловато-диффузной и далее диффузной формы,. морфологически характеризующейся полной перестройкой стенки БСДК.
Наблюдаемая при этом гипертрофия мышечных пучков является компенсаторной, возникающей в ответ на процессы перестройки стенки большого дуоденального сосочка.
У лиц, не страдающих желчнокаменной болезнью, аденомиоз выявляли не менее часто, чем у лиц с желчнокаменной болезнью и воспалительными изменениями желчных путей. Поэтому мы поддерживаем мнение Marzoli и Serio (1976) о том, что аденомиоз БСДК является процессом, не зависящим от патологии желчевыводящих путей. На основании большого сходства аденомиозных структур с гормонально обусловленными гиперилазиями молочной и предстательной желез можно считать обоснованным также предположение Lebert (1955) об эндокринной индукции аденомиоза БСДК.
В ряде случаев картины аденомиоза большого дуоденального сосочка могут представлять определенные трудности при дифференциальном диагнозе с опухолевым процессом, особенно, если исследованию подвергаются биоптаты небольших размеров. Однако, морфологические критерии свидетельствуют против опухолевого происхождения аденомиозных формаций, поскольку в них не наблюдается клеточной и ядерной атинии, отсутствуют митозы и признаки деструирующего роста.
Поэтому аденомиозные структуры следует отнести к числу опухолеподобных пролифератов гиперпластического происхождения.
Папиллярная аденома большого дуоденального сосочка.
Встречается редко. Внешний вид опухоли соответствует крупному полипу. Эпителиальный компонент аденомы предсгавлеп высоким призматическим эпителием со светлой эозинофильиой цитоплазмой и базально расположенным ядром, морфологические и функциональные свойства которого напоминают нормальный эпителий слизистой оболочки БСДК. Имеется некоторое сходство в гистологическом строении папиллярной аденомы и гиперпластических полипов БСДК. Существует даже мнение, что эти образования практически невозможно различить. Однако анализ морфофункциональных особенностей папиллярной аденомы и гиперпластических образований позволяет выделить признаки, являюпшеся основой для проведения дифференциального диагноза.
В гиперпластических полипах эпителиальные клетки сохраняют нормальное строение и ядра их располагаются строго однорядно вблизи базальной мембраны, митозы отсутствуют. Полипы имеют хорошо развитую строму из рыхлой соединительной ткани, богатую кровеносными сосудами и клеточными элементами, среди которых преобладают лимфоциты и плазматические клетки. В папиллярной аденоме эпителий приобретает черты атинии: клетки и ядра имеют большие, чем в норме, размеры; ядра становятся гиперхромными и сильно вытянутыми, они теряют строго полярное расположение, появляются митозы. Опухолевые клетки отличаются нарушением секреторной функции. В одних клетках аденомы выявляется резкая гиперсекреция слизи, в других секреция полностью отсутствует.
Строма в опухоли не столь развита, клеточный инфильтрат в ней более скудный и состоит преимущественно из лимфоцитов и фибробластов. Папиллярная аденома может малигнизироваться.
Источник
Эндоскопическая диагностика и лечение опухолей большого дуоденального сосочка
А. С. Балалыкин, Оноприев А. В., Муцуров Х. С., Катрич А. Н., Вербовский А. Н.
Москва, Краснодар
Актуальность
В настоящее время число воспалительных и опухолевых заболеваний поджелудочной железы, желчного протока и большого дуоденального сосочка (БДС), вызывающих непроходимость внепеченочных желчных протоков, продолжает увеличиваться и удельный вес рака БДС среди опухолей билиопанкреатодуоденальной зоны составляет 10,1–18,3 % (Русаков В. И. с соавт., 1986; Frosali D. et al., 1990).
Чрезвычайная злокачественность рака панкреато-биллиарной области и его поздняя диагностика приводят к тому, что хирургическое лечение больных сопровождается высоким операционным риском и невозможностью выполнения радикальных операций. Их частота составляет только 4–27 %, послеоперационная летальность достигает 8–22 %, а пятилетняя выживаемость — всего 4–6 % [М. В. Данилов соавт., 1995; А. А. Мовчун с соавт., 1994; В. А. Кубышкин с соавт., 2003].
Благодаря ранним клиническим проявлениям (механическая желтуха) опухоли БДС диагностируются на более ранней стадии, чем опухоли другой локализации. Существующие инструментальные методы исследования (эндоскопические, лучевые, лапароскопические) далеко не всегда позволяют сформулировать наиболее рациональную тактику и вид лечения, и главное, имеют существенные ограничения в оценке стадии болезни.
К 80-м годам прошлого столетия был разработан принципиально новый диагностический прибор — эхо-эндоскоп, соединивший в себе возможности гибковолоконной эндоскопии и ультразвукового исследования.
Отличительной особенностью и неоспоримым преимуществом метода перед другими является то, что ультразвуковой датчик под контролем зрения размещается в непосредственной близости от зоны исследования, что позволяет повысить разрешающую способность ультразвукового сканирования. Учитывая короткую дистанцию исследования, и доказанную корреляцию между получаемым ультразвуковым изображением и анатомическим строением стенки полых органов желудочно-кишечного тракта (ЖКТ), эндо-УЗИ позволяет произвести послойную структурную оценку БДС, окружающих его органов и тканей, сосудистых и протоковых образований в зоне исследования. Полученные данные позволяют установить диагноз и обосновать план лечения.
Материалы и методы исследования. Нами проанализированы результаты лечения 39 пациентов с подозрением на злокачественные новообразования диагностированные при обследовании 421 больных в 2004–2009 гг. в возрасте 35–77 лет.
Нами применен следующий инструментальный диагностический алгоритм: ТАУЗИ, фиброгастродуоденоскопия (ФГДС), эндо-УЗИ, эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ), фистулография, компьютерная томография (КТ) — по показаниям.
Несомненным преимуществом ТАУЗИ перед другими методами исследования является отсутствие противопоказаний и возможность использовать его в качестве экспресс-диагностического метода.
Перед ФГДС ставились следующие задачи: оценить проходимость верхнего отдела ЖКТ, выявить специфические изменения слизистой желудка и ДПК, характерные для сопутствующих заболеваний желудка и ДПК, определить доступность и состояние БДС и периампулярной области, оценить технические возможности проведения лечебных эндоскопических мероприятий на БДС.
Эндоскопическое ультразвуковое исследование.
Мы использовали видеоэндоскопический комплекс, EVIS EUS EXERA, «Olympus», Япония, включающий: видеоэндоскопический центр CV-160, осветитель CLV-160, ультразвуковой эндоскопический центр UM-60, радиальный ультразвуковой гастровидеоскоп GF-UM 160.
Подготовка больных к эндо-УЗИ панкреатобилиарной системы не отличается от таковой при обычной эндоскопии.
Проведению эндо-УЗИ обязательно должно предшествовать эндоскопическое или рентгенологическое исследование пищевода или желудка (для исключения стенозов, дивертикулов), поскольку введение эхоэндоскопа производится практически без визуального контроля.
Стандартные позиции проведения эндоскопического ультразвукового исследования различных органов были предложены M. Sivak (1982 г), и W. Strohm и M. Classen (1982) и утверждены Международной конференцией по эндоскопической эхографии (Стокгольм). В последствии методика была дополнена K. Inui et al. (2004).
Большой дуоденальный сосочек — осмотренный в поперечном сечении, представляется как дополнительное округлое (овальное) многослойное образование стенки нисходящего отдела ДПК. При идентификации структур БДС определяются поочередно мышечный слой ДПК (слой сниженной эхогенности), подслизистый слой ДПК (слой повышенной эхогенности), мышечный аппарат сфинктера (тонкий гипоэхогенный слой) и внутренний гиперэхогенный слой, соответствующий слизистому и подслизистому слою ампулы сосочка.
Для исследования БДС в продольном направлении необходимо смещение УЗ-датчика в проксимальном направлении, путем подтягивая эндоскопа. Основными ориентирами являются протоковые структуры; в этом случае ультразвуковая картина меняется индивидуально: соответственно анатомическим взаимоотношениям терминальных отделов желчного и панкреатического протоков, относительно друг друга и стенки ДПК.
Увеличение БДС в размерах более 1 см, выявление в просвете сосочка дополнительных образований, исходящих из его стенок, изменение эхографических характеристик многослойной структуры данного анатомического образования интерпретируется как патологическое изменение БДС.
Ультразвуковая семиотика заболеваний БДС. Эндоскопическими ультразвуковыми диагностическими критериями опухоли БДС являются: нарушение нормальной многослойной эхоструктуры БДС, солидное образование в проекции БДС, сниженная или смешанная эхо-генность образования, нечеткие контуры образования.
Опухоль может иметь экзофитную (в просвет ДПК) и эндофитную или инвертированную (в просвет дистальных отделов протоков) формы роста. На начальных стадиях роста и небольших размерах образования и при отсутствии инфильтративного роста надежных дифференциально-диагностических критериев карциномы и аденомы, не существует.
Эндоскопическими ультразвуковыми диагностическими критериями карциномы сосочка являются: распространение гипоэхогенных тканевых масс на мышечный слой стенки ДПК, в просвет холедоха и ГПП или на стенки протоков, в паренхиму поджелудочной железы, и/или обнаружение рядом с БДС лимфатических узлов подозрительных на их метастатическое поражение (Панцырев Ю. М. и соавт. 2002). Это- важные дифференциально-диагностические признаки, т. к. обнаружение хотя бы одного из них определяет тактику лечения и ставит под сомнение радикальность эндоскопической резекции опухоли. Недооценка указанных фактов приводит к неудовлетворительным результатам эндоскопических методов лечения.
Наиболее важными лимфатическими коллекторами, требующими детальной оценки для точного определения лимфогенного метастазирования опухоли БДС в процессе выполнения эндосонографии, являются лимфоузлы печеночно-двенадцатиперстной связки, задние поджелудочно-двенадцатиперстные лимфоузлы и верхнебрыжеечные лимфоузлы.
Так как опухоли БДС, которые инфильтрировали поджелудочную железу или периампулярную область, невозможно отличить от первичных панкреатических карцином, большинство авторов описывают их как «опухоли БДС» или «периампулярные раки». Так как оба типа в одинаковой степени склонны к метастазированию, нет необходимости в их дооперационной дифференцировке их локализации. Дооперационное определение стадии ампулярной карциномы базируется на основании Международной классификации по факторам TNM принятой европейской организацией «Union International Control Cancer».
Результаты
После комплексного применения диагностических методик у 36 из 421 обследованных пациента был установлен предварительный диагноз опухоли БДС, причем у 34 пациентов была заподозрена злокачественная природа процесса в стадии Т1 — у 7 (20,6 %), Т2 — у 16 (47 %), в стадии Т3 — у 11 (32,4 %) пациентов.
Нами была проанализирована диагностическая ценность инструментальных методов в диагностике опухолей БДС и установлено, что эндо-УЗИ имеет более высокую чувствительность, специфичность и диагностическую эффективность.
Показания к эндоскопическим методам лечения были выставлены у 7 пациентов. После применения комплекса диагностических методик, по макроскопической картине выявленные неоплазии были разделены на экзофитную и эндофитную (инвертированную) форму опухоли БДС. Размеры выявленных образований колебались в пределах от 8 до 32 мм. Морфологическая характеристика опухолей распределилась следующим образом: высокодифференцированная аденокарцинома, аденома с дисплазией III ст., аденома с дисплазией II ст.
Возможность выполнения эндоскопической эксцизии опухолей БДС (Балалыкин А. С. и соавт. 2008, Катрич А. Н. и соавт., 2008) обосновывалась данными эндо-УЗИ (тип роста образования, наличие измененных лимфатических узлов, состояние мышечного слоя стенки ДПК, терминальных отделов желчного и панкреатического протока). Всем пациентам был применен последовательный комплекс эндохирургических вмешательств, включавший атипичную «послойную» ЭПТ с помощью торцевого папиллотома, дополненная канюляционной ЭПТ у 6 больных, петельную электроэксцизию опухоли, электро — или аргоноплазменную деструкцию, а также вмешательства, направленные на обеспечение адекватного пассажа желчи и панкреатического сока (стент, НБД). Всем пациентам в послеоперационном периоде выполнялось желудочное и дуоденальное зондирование, проводился курс консервативной терапии. Контрольные обследования выполнялись в сроках от 3 до 6 месяцев.
Успех и безопасность эндоскопического вмешательства определяется правильным набрасыванием петли и рациональным сочетанием режимов резания и коагуляции, поэтому в зависимости от формы роста опухоли менялись технические аспекты выполнения данного этапа операции. В случае эндофитной формы роста опухоли после выполнения атипичной «послойной» ЭПТ, с помощью торцевого папиллотома выполнялись «полулунные» окаймляющие разрезы слизистой оболочки в пределах здоровых тканей, в 3 случаях дополненные введением с помощью инъектора, раствора в подслизистый слой, для создания «подушки» под тканью опухоли. С нашей точки зрения эти приемы обеспечивают:
1) адекватное набрасывание эндоскопической петли на опухоль;
2) снижают риск «сползания» петли;
3)резекцию «in block». С целью профилактики кровотечения и повышения абластичности операции выполнялась электро или аргоноплазменная деструкция зоны новообразования БДС. Обеспечение свободного пассажа желчи и панкреатического сока достигалось за счет выполнения билиопанкреатического стентирования.
Осложнениями оперативных вмешательств являлись: интраоперационное кровотечение, остановленное эндоскопически, микроперфорация ДПК, которая была излечена консервативно.
В одном случае, через 3 месяца после выполнения операции, при контрольном эндо-УЗИ, был выявлен продолжающийся рост опухоли. Пациенту была выполнена панкреатодуоденальная резекция.
Выводы
1. Методика эндоскопического ультразвукового исследования является наиболее эффективным методом диагностики заболеваний БДС, стадии злокачественного процесса и позволяет планировать объем и вид лечения больных. 2. Успех, радикальность и безопасность эндоскопической папиллэктомии определяется комплексностью эндоскопических методик и четким соблюдением этапности их выполнения. Включение в лечебный алгоритм стентирования протоков обеспечивает свободный пассаж желчи и панкреатического сока, и позволяет избежать послеоперационных осложнений.
Источник