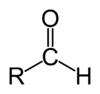
Альдегиды
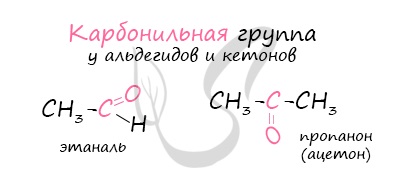
Альдегиды и кетоны весьма схожи, различие заключается в том, что последние имеют при карбонильной группе два заместителя. Поляризация двойной связи «углерод-кислород» по принципу мезомерного сопряжения позволяет записать следующие резонансные структуры:
Подобное разделение зарядов подтверждается физическими методами исследования и во многом определяет реакционную способность альдегидов, как выраженных электрофилов. В общем случае химические свойства альдегидов аналогичны кетонам, однако альдегиды проявляют бо́льшую активность, что связано с большей поляризацией связи. Кроме того, для альдегидов характерны реакции, не характерные для кетонов, например гидратация в водном растворе: у метаналя в связи с ещё большей поляризацией связи — полная, а у других альдегидов — частичная:
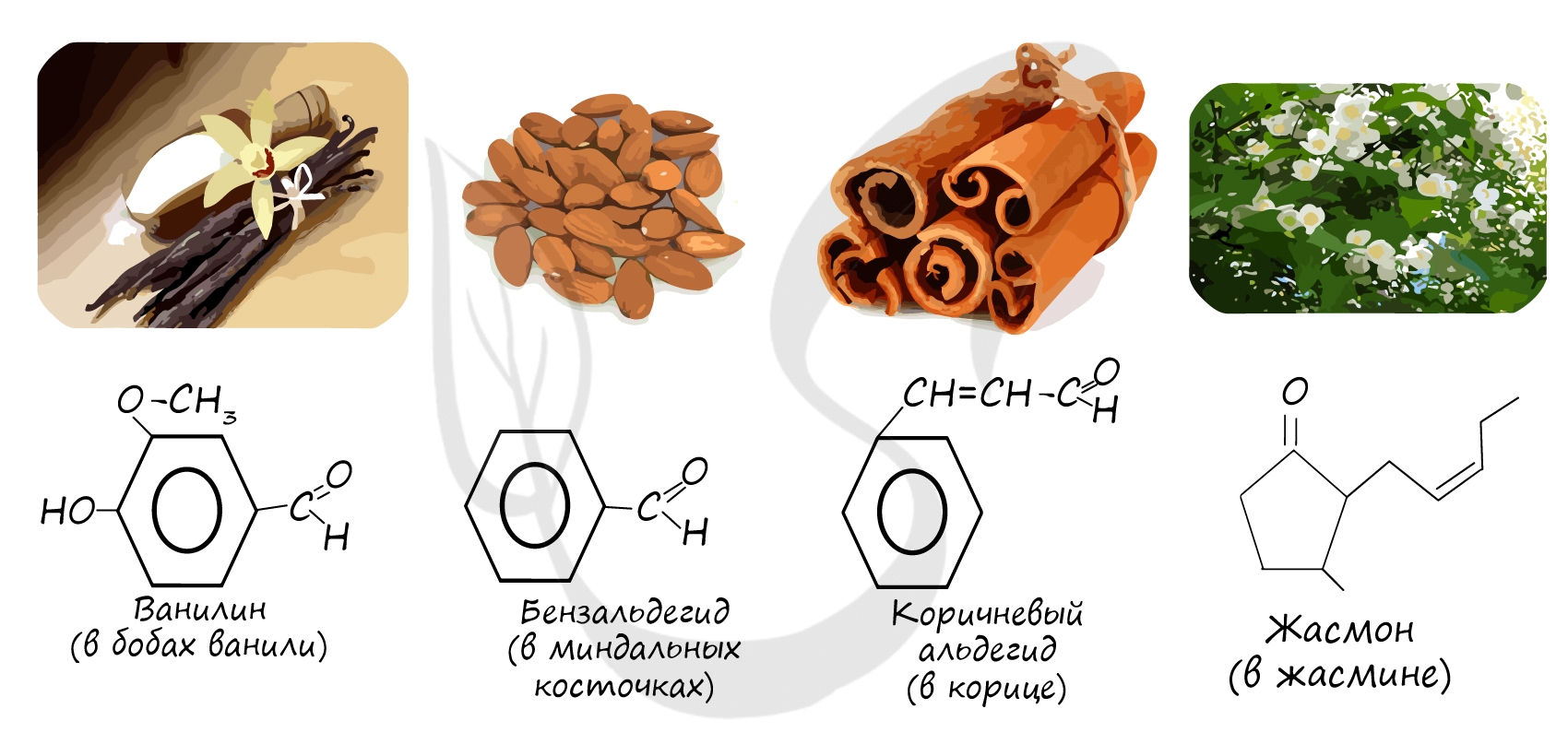
Простейшие альдегиды имеют резкий характерный запах (например, бензальдегид — запах миндаля).
Под действием гидроксиламина превращаются в оксимы:

| Название | Формула | Температура плавления | Температура кипения |
|---|---|---|---|
| Формальдегид | HCHO | −92 °C | −19 °C |
| Ацетальдегид | CH3CHO | −123 °C | 20,8 °C |
| Пропаналь | CH3CH2CHO | −81 °C | 48,8 °C |
| Бутаналь | CH3CH2CH2CHO | −97 °C | 75 °C |
| Акролеин | CH2=CH-CHO | −88 °C | 52,5 °C |
| Кротоновый альдегид | CH3-CH=CH-CHO | −76,5 °C | 104 °C |
| Бензальдегид | C6H5-CHO | −56 °C | 179 °C |
| Салициловый альдегид |  | 1,6 °C | 197 °C |
| Фурфурол | 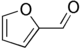 | −36,5 °C | 161,7 °C |
Химические свойства
Высокая реакционноспособность связана с наличием высокополярной связи С=О. Проявляют свойства органических оснований.
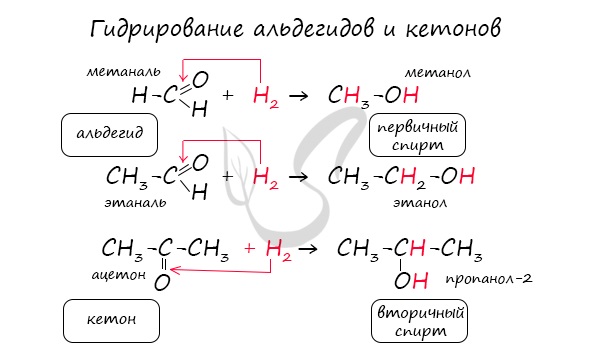
Восстановление. Альдегиды способны к восстановлению, основной продукт восстановления — первичные спирты.
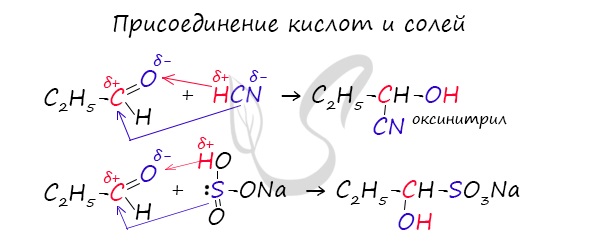
Присоединение синильной кислоты. Используется для удлинения углеродной цепи.
Присоединение гидросульфита натрия. Используется для выделения альдегидов из растворов.
Присоединение спиртов с образованием полуацеталей (при избытке спирта и хлороводороде образуются ацетали)
2 Окисление. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты.
Реакция «медного зеркала». Окислителем здесь выступает свежеприготовленный гидроксид меди(II). Образуется кирпично-красный осадок оксида Cu(I)
3 Реакция полимеризации
Формальдегид образует параформальдегид (n=8-100) при длительном стоянии или испарении.
При циклизации образуются триоксан (n = 3) и тетраоксиметилен (n = 4).
4 Реакция поликонденсации При нагревании альдегида с фенолом в кислой или щелочной среде образуются фенолформальдегидные смолы.
Биологическое действие
Токсичны. Способны накапливаться в организме. Кроме общетоксического, обладают раздражающим и нейротоксическим действием. Эффект зависит от молекулярной массы: чем она больше, тем слабее раздражающее, но сильнее наркотическое действие, причём ненасыщенные альдегиды токсичнее насыщенных. Некоторые обладают канцерогенными свойствами [1] .
С другой стороны — альдегиды входят в состав пищевых продуктов и эссенций (например, ананасовой [2] ). Любое вещество, даже самое необходимое, может вызывать токсические эффекты. Действие вещества определяется дозой. В силу сходства химического строения все альдегиды обладают указанными у Лойта [1] свойствами, только чтобы они проявились, нужно принять дозу вещества много бо́льшую, чем содержится в пачке миндального печенья. Среднесмертельная доза ароматизатора бензальдегида (для крыс при пероральном введении) составляет 1300 мг на килограмм массы тела (для сравнения: у хлорида натрия среднесмертельная доза — 3000 мг/кг ). У «настоящего яда» формальдегида LD50= 100 мг/кг .
См. также
Примечания
- ↑ 12 Общая токсикология / под ред. А. О. Лойта. СПб.: ЭЛБИ-СПб., 2006
- ↑запись «Эссенция» в словаре Брокгауза и Ефрона на Яндексе
Ссылки
- Альдегид // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб. , 1890—1907.
- Альдегиды — номенклатура, свойства, получение, применение.
 Органические вещества Органические вещества | |
|---|---|
| Углеводороды | Алканы · Алкены · Арены · Алкины · Диены · Циклоалканы |
| Кислородсодержащие | Спирты · Простые эфиры · Альдегиды · Кетоны · Кетены · Карбоновые кислоты · Сложные эфиры · Ортоэфиры · Углеводы · Жиры · Хиноны · Фенолы · Енолы · Оксикислоты · Оксокислоты |
| Азотсодержащие | Амины · Окиси аминов · Амиды · Гидразиды · Нитросоединения · Нитрозосоединения · Оксимы · Нитрилы · Изонитрилы · Аминокислоты · Белки · Пептиды |
| Серосодержащие | Меркаптаны · Тиоэфиры · Сложные тиоэфиры · Дисульфиды · Сульфокислоты · Тиоальдегиды · Тиокетоны · Тиокарбоновые кислоты |
| Фосфорсодержащие | Фосфины · Фосфонистые кислоты · Фосфиновые кислоты · Фосфоновые кислоты · Нуклеиновая кислота · Нуклеотиды |
| Галогенорганические | Фторорганические соединения · Хлорорганические соединения · Броморганические соединения · Иодорганические соединения |
| Кремнийорганические | Силаны · Силазаны · Силтианы · Силоксаны · Силиконы |
| Элементоорганические | Германийорганические · Борорганические · Оловоорганические · Свинецорганические · Алюминийорганические · Ртутьорганические · Другие металлоорганические |
| Другие важные классы | Галогенуглеводороды · Гетероциклические соединения · Перфторуглеводороды |
 Альдегиды Альдегиды | |
|---|---|
| Предельные | Формальдегид · Ацетальдегид · Хлораль · Пропаналь · Бутаналь · Нонаналь · Деканаль · Додеканаль · Глиоксаль · Малондиальдегид |
| Непредельные | Акролеин · Кротоновый альдегид · Мирценаль · Цитраль · Цитронеллаль |
| Ароматические | Бензальдегид · Салициловый альдегид · Коричный альдегид · Анисовый альдегид · Ванилин · Этилванилин · Гелиотропин |
| Гетероциклические | Фурфурол · Пиридоксаль |
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Альдегиды» в других словарях:
Альдегиды — представляют значительную и важную группу органических соединений, члены которой хотя и не часто встречаются в отдельном состоянии в природе, но без сомнения играют чрезвычайно существенную роль в различных физиологических процессах как животного … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
АЛЬДЕГИДЫ — летучие жидкости органического состава, образуются из алкоголя, путем окисления его. Полный словарь иностранных слов, вошедших в употребление в русском языке. Попов М., 1907. АЛЬДЕГИДЫ летучие жидкости органического состава; имеют приятный запах… … Словарь иностранных слов русского языка
альдегиды — ов, м. aldéhyde m, f. 1845. Лексис. В химии органические соединения, являющиеся продуктом неполного окисления спирта. БАС 2. Профессор химии в Валь де Грасе открыл, что альдегид имеет те же анестезические свойства, как серный эфир и хлороформ. ОЗ … Исторический словарь галлицизмов русского языка
АЛЬДЕГИДЫ — АЛЬДЕГИДЫ, органические соединения, содержащие альдегидную группу CHO, например формальдегид, ванилин. Применяют в производстве полимеров, как душистые вещества и др … Современная энциклопедия
АЛЬДЕГИДЫ — органические соединения, содержащие альдегидную группу CHO. Примеры альдегидов формальдегид, ацетальдегид, бензальдегид, акролеин, ванилин. Получают окислением первичных спиртов и др. методами. Применяют в производстве полимеров, органическом… … Большой Энциклопедический словарь
АЛЬДЕГИДЫ — [от al(cohol) dehyd(roge natus), т. е. алкоголь, лишенный водорода], органические соединения, характеризую щиеся присутствием в их молекуле типич ной группировки Сч , называемой альдегидной группой. Некоторые А. образуются как промежуточные… … Большая медицинская энциклопедия
Альдегиды — АЛЬДЕГИДЫ, органические соединения, содержащие альдегидную группу CHO, например формальдегид, ванилин. Применяют в производстве полимеров, как душистые вещества и др. … Иллюстрированный энциклопедический словарь
АЛЬДЕГИДЫ — класс органических соединений, содержащих в молекуле карбонильную группу >С=0, связанную с органическим радикалом (R) и атомом водорода. Общая формула A. RC(0)H. Благодаря присутствию карбонильной группы А. легко вступают в реакции замещения и… … Большая политехническая энциклопедия
альдегиды — ов; мн. (ед. альдегид, а; м.). [искаж. лат. al(cohol) dehyd(rogenatum) алкоголь, лишённый водорода]. Хим. Органические соединения, продукт дегидрирования первичных спиртов (применяются в производстве полимеров или органическом синтезе и т.п.).… … Энциклопедический словарь
Альдегиды — класс органических соединений, содержащих карбонильную группу связанную c органическим радикалом (R) и с атомом водорода, Свойства А. во многом сходны со свойствами кетонов, также содержащих карбонильную … Большая советская энциклопедия
Источник
Альдегиды
Альдегиды — летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.
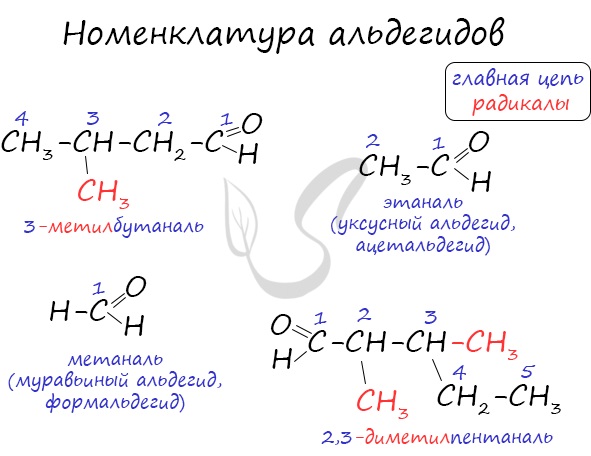
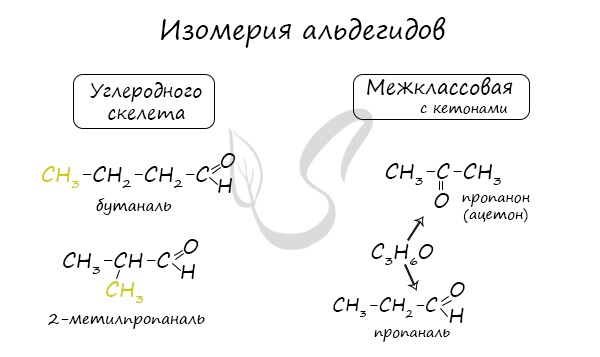
Номенклатура и изомерия альдегидов
Названия альдегидов формируются путем добавления суффикса «аль» к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот — HO. Например: метаналь — HCHO, этаналь — CH3CHO, пропаналь — C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь — формальдегид, этаналь — ацетальдегид. Замечу, что формалином называется 40% раствор формальдегида.
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
Получение альдегидов и кетонов
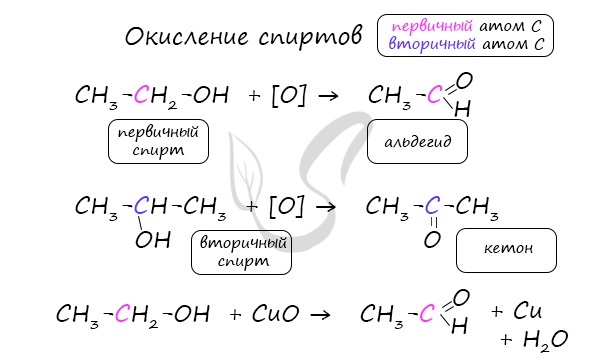
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов — кетоны. Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов.
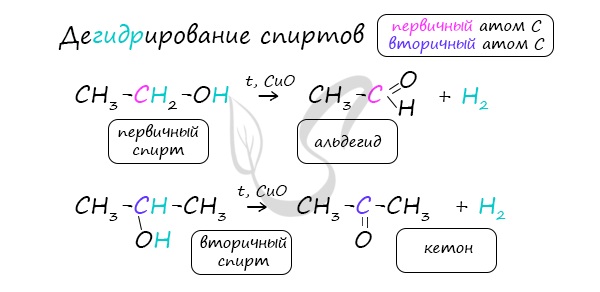
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа.
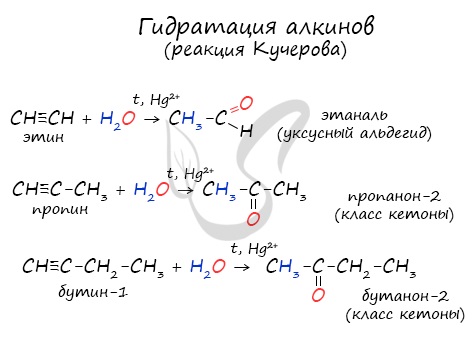
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны.
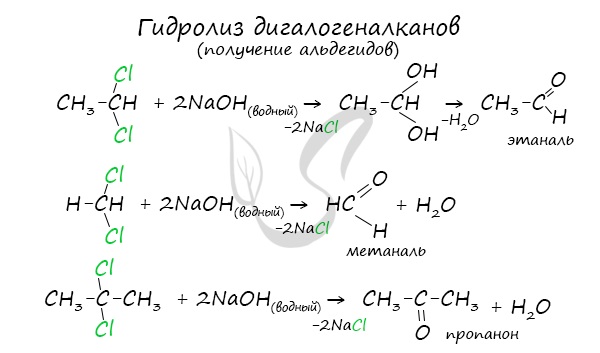
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов — у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.
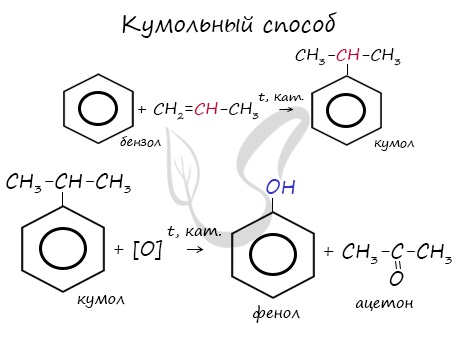
В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.
Химические свойства альдегидов и кетонов
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе. Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов — вторичных спиртов.
В результате полного окисления, горения, образуется углекислый газ и вода.
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли
Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая распадается на углекислый газ и воду. Это связано с интересным фактом — наличием альдегидной группы у муравьиной кислоты.
Окисление также возможно другим реагентом — гидроксидом меди II. Эта реакция также относится к качественным для альдегидов, в результате образуется кирпично-красный осадок оксида меди I.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник